Cell:清华俞立团队首次发现迁移体介导的线粒体胞吐,一种新型线粒体质控过程
丁香学术
519
细胞迁移是指细胞在接收到迁移信号或感受到某些物质的梯度后而产生的移动。绝大多数细胞都存在细胞迁移的现象,并具有一定的迁移能力,这也是正常细胞的基本功能之一,是机体正常生长发育的生理过程。
胚胎形态发生、血管生成、伤口愈合、免疫监控、炎症反应、组织修复和再生、癌症转移等过程中都涉及细胞迁移。在细胞运动过程中,细胞尾部会生成管状结构,称为收缩丝;随着迁移运动的发生,细胞收缩丝的尾部或交叉处生成囊泡样结构,即为迁移体 (Migrasome)。
迁移体,一种细胞亚结构,是近年来由清华大学俞立教授团队发现的一种膜性细胞器,迁移体的大小大约在 0.5 μm 到 3 μm 之间,膜泡内还包含着数量不等的直径在纳米级别的小囊泡。迁移体的产生依赖于细胞的迁移运动,可作为一种新的方式向胞外释放胞质成分。
2021 年 5 月 27 日,清华大学生命科学学院俞立教授课题组在 Cell 在线发表题为 Mitocytosis, a migrasome-mediated mitochondrial quality-control process 的研究论文。
研究发现在线粒体胞吐的过程中,迁移细胞选择性地去除受损的线粒体以维持体内平衡。该研究首次阐明与迁移有关的线粒体胞吐增多是迁移细胞中线粒体质量控制的选择性机制,线粒体胞吐将线粒体稳态与细胞迁移有机地耦合在一起。

图片来源:Cell
研究内容
1、轻度线粒体应激能够触发线粒体胞吐的发生
研究人员使用 TSPAN4-GFP 标记迁移体,MitoDsRed 标记线粒体,发现药物 CCCP 处理后,迁移体内部的出现 MitoDsRed 信号,说明线粒体被迁移体所吞噬。通过分子水平验证药物处理前后分离出的迁移体上的标志蛋白,同样发现线粒体标志蛋白在迁移体中积累。
透射电子显微镜(TEM)分析显示,CCCP 处理后,线粒体确实积聚在迁移体内。该研究还发现低浓度的 CCCP (1 mM) 就足以诱导线粒体胞吐,10 mM CCCP (用于诱导线粒体自噬的剂量) 处理的细胞中,几乎不会诱导线粒体胞吐。轻度线粒体应激触发的线粒体向迁移体转运并使线粒体被迁移体从细胞中清除,研究人员将此过程称为线粒体胞吐(mitocytosis)。
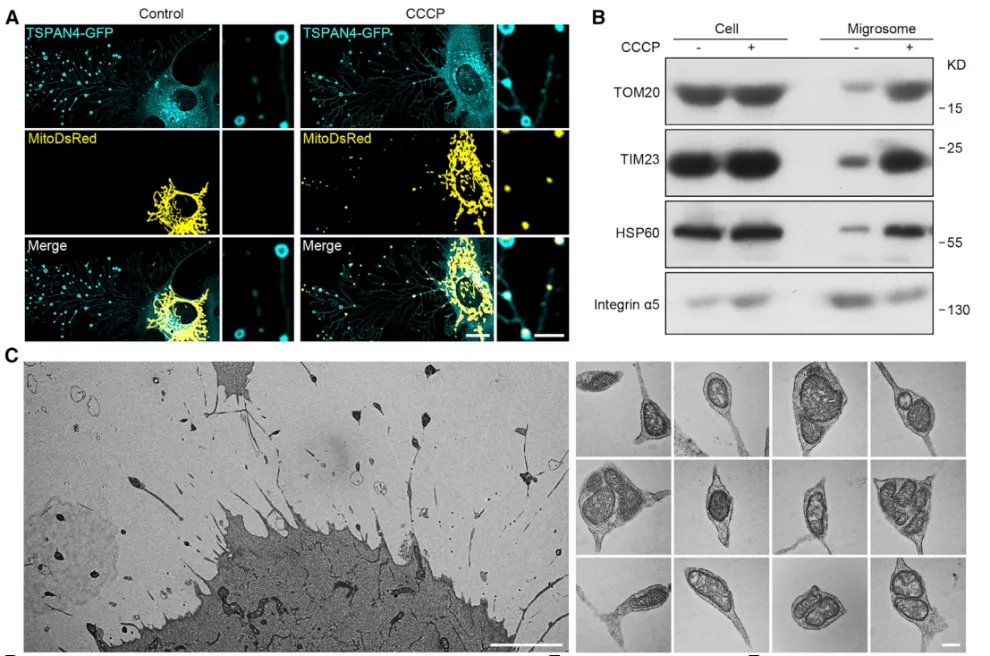
图片来源:Cell
在线粒体胞吐过程中,高度动态的管状线粒体向外延伸。一旦管状线粒体的尖端接近质膜,尖端就会从线粒体网络中裂变,产生碎片附着在靠近质膜的区域。最终,当细胞迁移出去时,「被困」的线粒体碎片留在收缩纤维上,随后进入迁移体。
在紧邻质膜上方细胞底部的区域中,几乎所有的线粒体都具有浓缩的基质和肿胀的嵴,这表明这些线粒体受到了破坏。这些受损的线粒体中的一些位于回缩纤维的入口。用 2 mM CCCP 处理可增加细胞底部的线粒体数量。在细胞的中间部分(沿 y 轴),即使在接受 2 mM CCCP 处理的细胞中,大多数线粒体仍保持其正常形态。这些数据表明受损的线粒体被转运至细胞底部,通过线粒体胞吐而留在细胞后。
研究还明确了 KIF5B 通过将线粒体牵引至质膜来介导线粒体胞吐,而 Myo19 则将线粒体束缚在与质膜紧密相关的皮质肌动蛋白上。最后,与皮质肌动蛋白结合的管状线粒体尖端经历 Drp1 介导的裂变,然后被转运至迁移体。
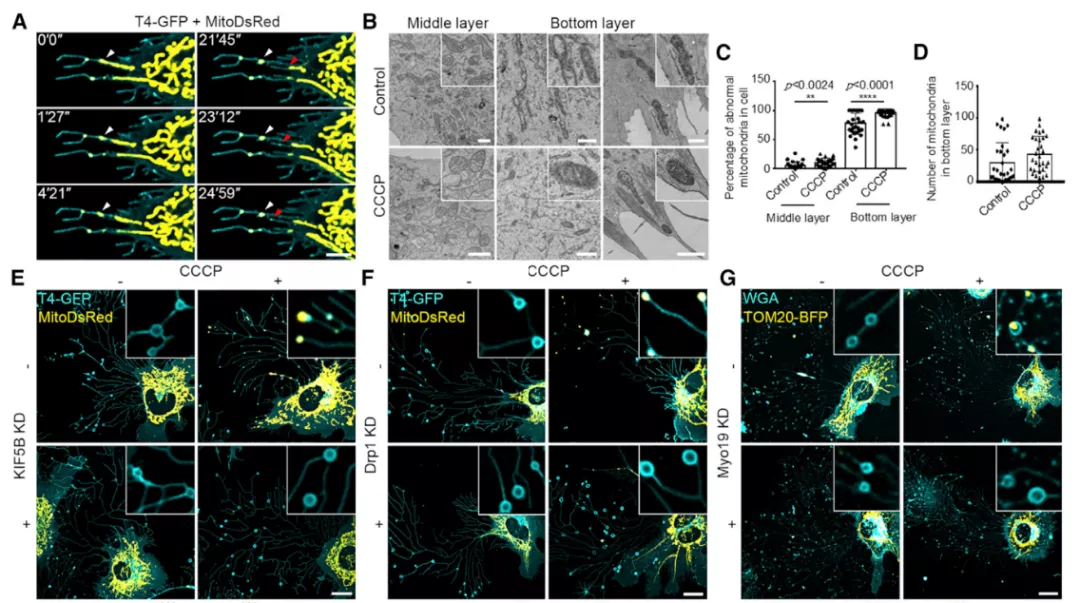
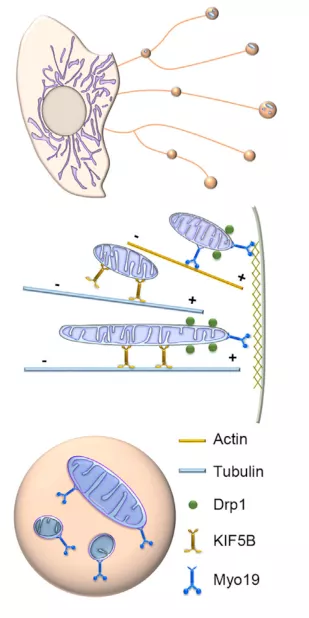
图片来源:Cell
与不发生迁移的细胞相比,迁移细胞需要消耗更多的能量来支持细胞迁移,因此它们可能具有更高的呼吸速率,更多的 ROS 生成和更高的线粒体压力负荷。
透射电镜图像显示,迁移体中大多数线粒体基质浓缩和嵴肿胀,提示这些线粒体可能受到损伤。为了直接检验这一假设,该研究使用 MitoSOX 对细胞进行了染色,结果表明迁移体内的绝大多数线粒体都是 MitoSOX 阳性的,并且通过线粒体探针 TMRM 染色证实迁移体内的线粒体已经失去了线粒体膜电位。
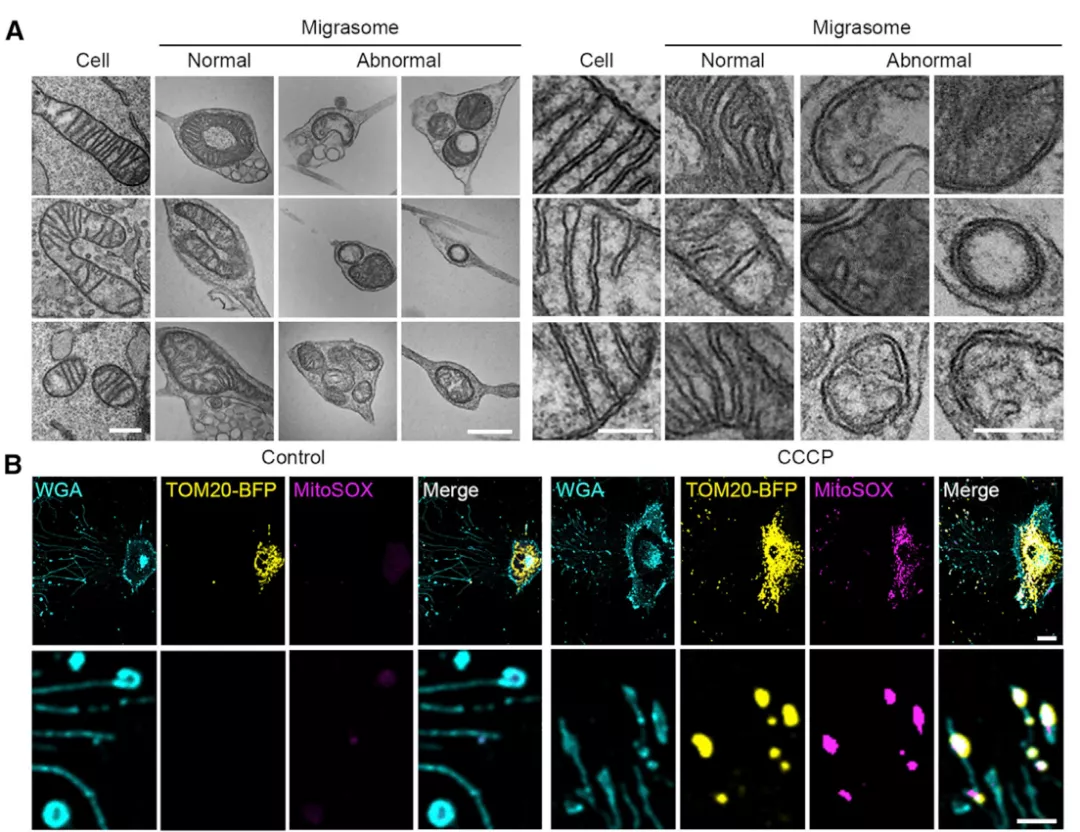
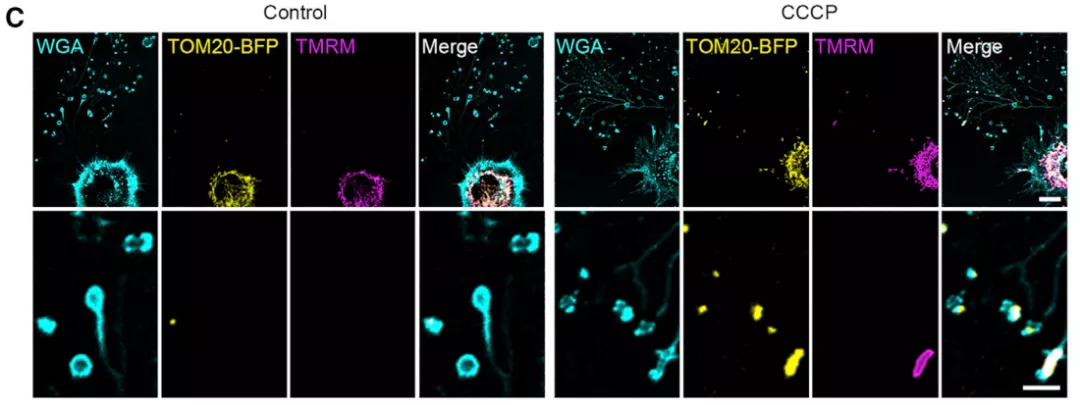
图片来源:Cell
2、肌动蛋白选择性结合受损的线粒体
那么受损的线粒体如何被感知并转运到迁移体中呢?TEM 分析表明,受损的线粒体可能被选择性地转运至细胞周围。
为了验证该假设,该研究首先分析了 KIF5B 和动力蛋白在分离的线粒体上的募集。研究发现,用 10 mM CCCP 处理细胞会显著降低肌动蛋白的线粒体募集并增加 KIF5B 的募集。相比之下,用 2 mM CCCP 处理细胞只会稍微降低动力蛋白在线粒体上的募集,而对 KIF5B 的招募无明显影响。因为在此剂量下,只有极小部分的线粒体被破坏。其次,该研究通过设计一系列的实验以进一步验证这一观察结果。研究发现,在经 CCCP 处理的细胞中,受损的线粒体选择性和肌动蛋白结合,通过 KIF5B 向线粒体的募集而后向细胞外围移动。
3、线粒体胞吐保护细胞免受线粒体应激压力
为了提高线粒体向迁移体的转运,研究发现敲低肌动蛋白的表达后,线粒体向迁移体的转运增强,过表达 TSPAN4 或 TSPAN9 或敲低动力蛋白可显著保护细胞免受 CCCP 诱导的线粒体膜电位丢失。
为了测试这种保护作用是否是由于线粒体胞吐所致,作者在 TSPAN4/TSPAN9 过表达且肌动蛋白敲低的细胞中敲除了 KIF5B,发现 KIF5B 敲除消除了 TSPAN4 过表达和肌动蛋白除的保护作用,结果证实此保护作用是由于线粒体胞吐造成的。通过对线粒体呼吸能力的测定,发现在 CCCP 治疗后 TSPAN4/TSPAN9 的过度表达,或强力蛋白的敲除都保留了线粒体呼吸能力。最后,通过评估线粒体自噬水平作为线粒体损伤程度,研究发现 2 mM CCCP 处理诱导了一个微弱的线粒体自噬信号,该信号可以通过增强的线粒体胞吐作用减弱。

图片来源:Cell
4、线粒体胞吐可维持巨噬细胞和中性粒细胞的的线粒体质量
该研究中,研究发现骨髓来源的巨噬细胞(BMDMs)可以在没有任何涂层的玻璃表面形成迁移体,但在经过亲水处理的表面上不能形成迁移体,这大大减少了巨噬细胞的迁移。而且,在亲水表面简单培养 BMDMs 会导致 MMP(线粒体膜电位)的显著丢失,这表明迁移体的形成是维持 BMDMs 中 MMP 的必要条件。
为了进一步测试线粒体胞吐在 BMDM 中的作用,该研究设计了 TSPAN9 基因敲除小鼠,并从 WT 和 TSPAN9-/- 小鼠中分离了单核细胞,然后将它们离体分化为 BMDM。研究发现源自 TSPAN9-/- 小鼠的 BMDM 中,迁移体明显减少。此外,与野生型小鼠相比,这些 BMDMs 的 MMP 有显著损失。
为了确定膜电位的丧失是由线粒体胞吐还是由独立于线粒体胞吐的 TSPAN9 引起的,研究人员用 TSPAN9 转染了 TSPAN9-/- 巨噬细胞,然后在未经处理的表面或亲水性表面上培养这些巨噬细胞,发现 TSPAN9 可能通过线粒体胞吐来调节 MMP。
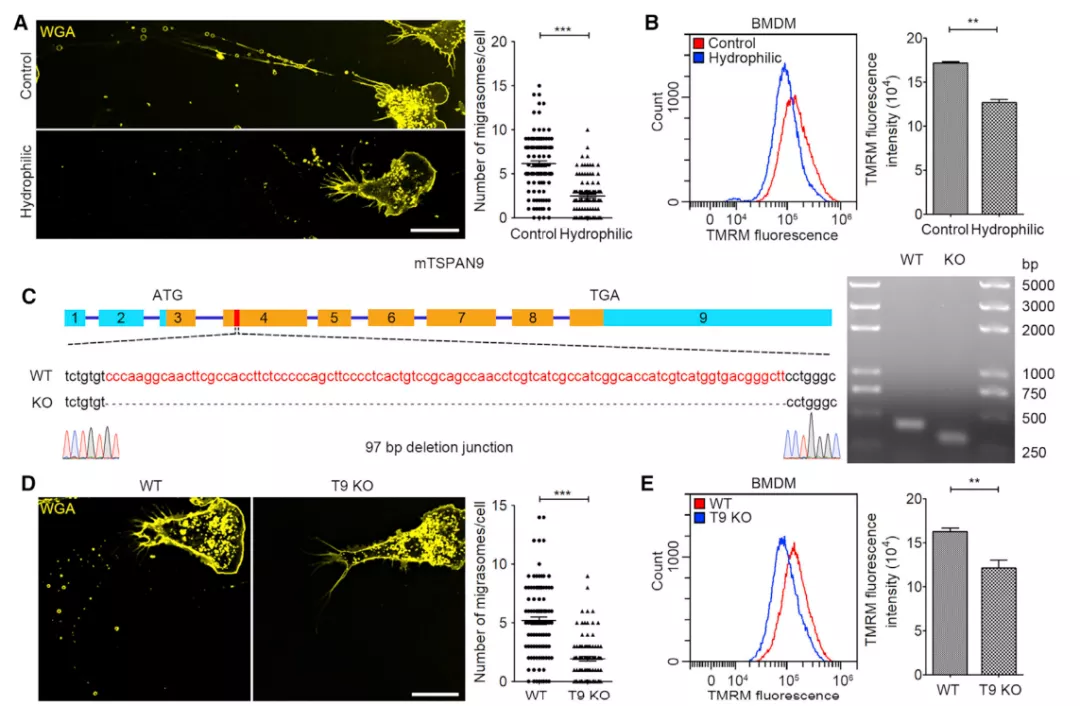
图片来源:Cell
在中性粒细胞中,该研究首先判断了中性粒细胞产生的迁移体是否含有线粒体。将中性粒细胞分离出来用 Mito-SOX 染色来标记受损的线粒体,然后将这些中性粒细胞注射回小鼠体内,发现确实有许多中性粒细胞产生的迁移体含有 Mito-SOX 信号。其次,通过对血液中分离出迁移体进行鉴定发现大约 87% 的迁移体来自中性粒细胞。通过 TEM 观察发现分离出的迁移体高度均一,并具有迁移体的形态特征,而且许多孤立的迁移体都含有受损的线粒体,这就证明了线粒体胞吐同样能够在体内发生。

图片来源:Cell
研究总结
综上所述,该项研究作为科学界首次提出并阐明在线粒体胞吐过程中,迁移细胞通过迁移体有选择地清除损坏的线粒体以维持机体稳态,将线粒体稳态与细胞迁移有机地耦合在一起。
本研究对领域内研究人员洞悉生命现象和过程具有极大的科学指导意义,充分体现出微观与宏观、分析与综合相结合,由定性走向定量,由单一走向多学科相互交叉的特征。
专访俞立教授:与新型膜性细胞器发现者,共讨迁移体的已知与未知
三句话读懂一篇 CNS:喝酒为何拉近社交距离;教科书级成果,RNA 糖基化修饰...
文章链接:https://doi.org/10.1016/j.cell.2021.04.027