Science 背靠背!施一公、黄志伟团队同日揭开 B 细胞受体复合物的神秘面纱
丁香学术
机体的免疫系统可以检测和识别多种不同类型的病原体,例如病毒、细菌和寄生虫。一旦检测到外来细胞或蛋白质,免疫系统就会产生抗体来对抗入侵者。
其中,人类适应性免疫细胞(T 细胞和 B 细胞)在病原感染、癌症发生以及自体免疫疾病中发挥着关键作用。它们分别通过 T 细胞受体(TCR)和 B 细胞受体(BCR)识别抗原信号,把信号跨膜传递至胞内,激活 T、B 细胞的免疫反应。
目前使用的几乎所有疫苗都依赖于通过与识别抗原并刺激抗体产生的 B 细胞受体结合来激活 B 细胞。详细了解 BCRs 的结构和功能,可以为疫苗的研发、开发癌症治疗方法以及控制和预防自身免疫性疾病的疗法提供信息。
2022 年 8 月 19 日,哈工大黄志伟教授团队和西湖大学施一公团队在顶级学术期刊 Science 背靠背发表了论文,各自解析了 B 细胞受体复合体结构。
两项研究分别为 Cryo-EM structures of two human B cell receptor isotypes 和 Cryo-EM structure of the human IgM B cell receptor。

图片来源:Science

图片来源:Science
黄志伟团队解析了人 IgG 和 IgM 两种同种型的 B 细胞受体的蛋白复合物结构。
复合物中包含了一个膜结合形式的免疫球蛋白(mIg)同源二聚体,这部分的主要功能是识别抗原;同时一个膜结合形式的 Igα/β(CD79α/CD79β)异二聚体,这部分的主要功能是信号传递。其中,mIg 二聚体包含了两段结构区域,分别是 Fab 和 Fc 结构域。
sIgM 在一般情况下会以五聚体的形式发挥最终功能,但是当膜结合的静息态 B 细胞受体时候,观察到了 IgM 的单体状态。为什么会出现这一状态呢?
研究人员通过进一部分的结构分析发现,Igα 的 Ig 样结构域和膜结合的 IgM-Cμ4 完全吻合。B 细胞受体的激活的过程,也是其逐渐多聚化的过程,而当 B 细胞受体静息状态下的时候,因为 Igα/β 的 Ig 样结构域与 Cμ4 或 Cγ3 结合,这就导致了在空间上隔挡了 mIg 多聚化,使得其出于单体状态,而当抗原结合后,会对 Fab 结构域潜在施加一定的机械力,从而引发 mIg_Fc 的构象改变,进一步的将蛋白的寡聚体界面暴露出来,最终使得 B 细胞受体多聚,引发下有信号的激活,但具体的机制仍然需要下一步的深入研究。

IgG 和 IgM 两种同种型的 B 细胞受体的蛋白复合物结构(来源:Science)
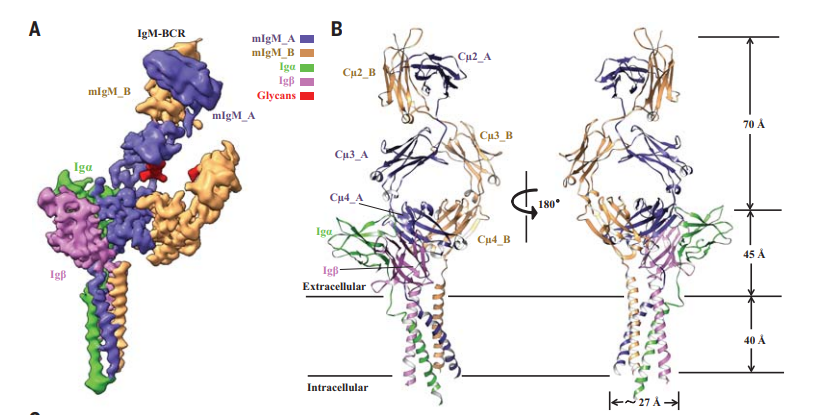
施一公研究团队的主要工作是解析了人源 IgM 同种型 B 细胞受体(IgM-BCR)的高分辨率电镜结构,在对结构的分析过程中,研究人员揭示了膜结合的 IgM(mIgM)与 Igα 和 Igβ 异源二聚体复合物组装的机制。
而这个过程要得益于他们精巧的实验设计,研究人员首先将四个组分通过密码子优化并克隆到相应的表达载体上,同时使用共表达方式,通过表达内质网蛋白 pERp1,pERp1 可以促进 IgM 二硫键的形成,二硫键有助于 IgM-BCR 正确折叠和结构稳定。
在完成蛋白的表达和纯化后,在溶液中加入抗体偶联药物 Polatuzumab vedotin 的 Fab 片段,最后通过冷冻电镜解析了第一个人源 IgM 同种型 B 细胞受体复合物 3.3Å 的高分辨率结构。
这篇文章所获得的结构,包含了复合物几乎胞外结构域以及所有跨膜区域, 包含一个 mIgM 和一个 Igα/Igβ 异源二聚体复合物。除此之外,在 Igβ 的上方,观察到了 Fab 片段的电子密度,进一步证实了 Polatuzumab 结合在 Igβ 柔性区域,有助于进一步增强人们对于相关机制的认识。
同期出版的评论文章也写到,「这些结构对理解 B 细胞识别抗原至关重要。」通过一系列的研究,相信人类将对基于 B 细胞受体或者抗原入侵过程更加清晰,也为未来的药物开发提供了高分辨率的模版和结构基础。

图片来源:Science