Nature:癌症疫苗新突破!调动 T 细胞与 NK 细胞的双重攻击,全面杀灭癌细胞
丁香学术
导读
疫苗的发明,可谓是人类发展史上一件具有里程碑意义的事件。从牛痘疫苗、狂犬病疫苗到新冠疫苗,研发、生产并接种疫苗,在控制甚至是消灭传染性疾病中发挥了不可磨灭的作用。
说到癌症疫苗,我们第一个想到的可能就是 HPV 疫苗,这是一种预防性癌症疫苗,可以通过预防感染人乳头瘤病毒而导致的癌症。而我们这篇文章要讲的,是一种治疗性癌症疫苗,可以刺激免疫系统识别和攻击癌细胞,以达到癌症治疗的目的。
当前,大多数癌症疫苗是以肽抗原为靶点进行设计的,而将多肽传递给 T 细胞则需要主要组织相容性复合体(MHC),然而 MHC 在个体之间的异质性较大,因此需要精准、个性化的癌症疫苗。此外,肿瘤也经常通过干扰肽递呈的机制来逃脱 T 细胞介导的免疫杀伤作用。
前期的研究结果表明,通过膜结合的 MICA 和 MICB(MICA/B)激活 NKG2D 受体能够触发自然杀伤细胞(NK)的细胞毒性程序和 CD8+ T 细胞的共刺激信号转导。然而,许多人类肿瘤通过细胞表面 MICA/B 的蛋白水解而逃避这一重要的免疫识别途径。
2022 年 5 月 25 日,来自美国波士顿 Dana-Farber 癌症研究所、哈佛医学院免疫学系等单位的研究人员在 Nature 期刊发表了题为 A vaccine targeting resistant tumours by dual T cell plus NK cell attack 的文章,报道了他们开发了一种以肿瘤免疫逃逸机制为靶点的新型癌症疫苗,可以诱导不同的 T 细胞和 NK 细胞进行协同攻击。
该疫苗诱导产生的抗体通过抑制蛋白水解而增加肿瘤细胞表面 MICA/B 蛋白的密度,以此增强树突状细胞对 T 细胞肿瘤抗原的呈递,并增强 NK 细胞的细胞毒性功能。此外,他们还发现该疫苗在手术切除原发性转移性肿瘤后进行免疫接种,依然可以抑制转移瘤的后期生长。
图片来源:Nature
主要研究内容
针对 MICA/B α3 结构域设计的疫苗
研究人员针对 MICA/B 高度保守的 α3 结构域,即蛋白水解脱落的部位,进行肿瘤疫苗的设计,并特意保留了 α1-α2 结构域,以避免诱导的抗体阻断 NKG2D 受体的结合。疫苗抗原的多价性极大地增强了免疫原性。
此外,最近开发的生物可降解支架介孔二氧化硅棒(MSR),招募树突状细胞(DC)的粒细胞-巨噬细胞集落刺激因子(GM-CSF)和佐剂 CpG ODN 1826 都被整合到该疫苗设计中。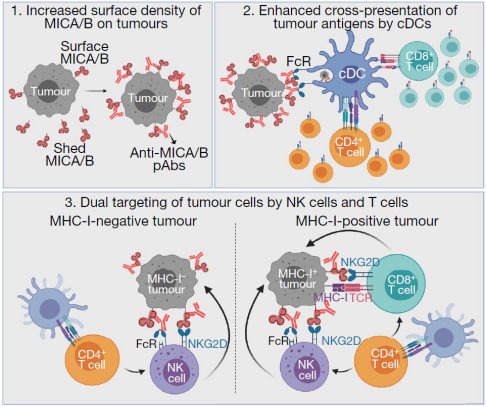
图片来源:Nature
对转移性肿瘤的疗效
后续的实验结果表明,MICB α3 域疫苗(MICB-vax)可诱导高滴度的抗体,同时还能诱导 CD4+ T 细胞的增殖和增强 CD8+ T 细胞对 MICB 的反应。在体内,MICB-vax 可明显抑制 MICB 的脱落,并大大增加了细胞表面密度 MICB 的水平以及抗肿瘤作用。
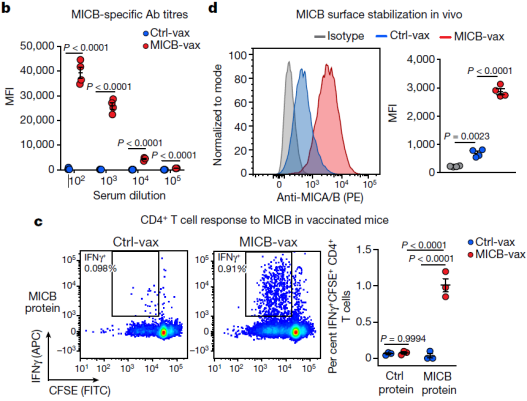
图片来源:Nature
为了评估 MICB-vax 诱导的免疫记忆,在初次免疫 4 个月后,他们用肿瘤细胞重新攻击无肿瘤小鼠,发现其可完全受到保护。
另外,利用两个自发转移模型,B16-BL6 黑色素瘤模型和 4T1 三阴性乳腺癌模型。他们发现在切除原发肿瘤后,小鼠在接种了 MICB-vax 或 Ctrl-vax 后,MICB-vax 可显著降低两种模型术后 1 个月以上的肺转移数量。肺组织切片的组织学分析进一步表明,与 Ctrl-vax 相比,MICB-vax 可显著减少转移数量和转移大小。
他们还在恒河猴中检测了疫苗的安全性和免疫原性,发现抗 MICA 和抗 MICB 抗体在后续加强免疫后滴度增加了 100~1000 倍,并且免疫接种后无临床副作用或血液化学变化,这为疫苗临床应用的安全性提供了初步证据。
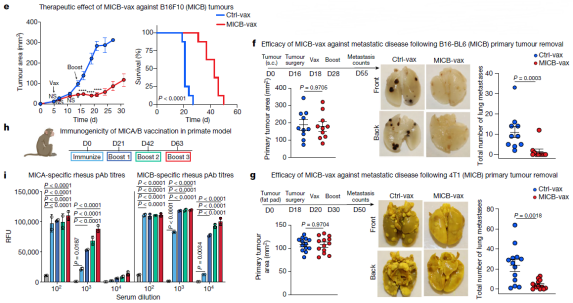
图片来源:Nature
T 细胞和 NK 细胞的募集
接下来,他们使用侵袭性 B16F10 黑色素瘤模型来研究疫苗发挥作用的机制。当对照组小鼠的肿瘤已经达到终点时,实验小鼠的肿瘤体积更小或无法检测,体现了 MICB-vax 的有效性。
在 MICB-vax 免疫小鼠的肿瘤中,多个效应淋巴细胞群体大量富集,其中 CD4+ T 细胞富集倍数为 29.3 倍,CD8+ T 细胞富集约 17.9 倍,NK 细胞富集约 38.9 倍。此外,CD4+ 和 CD8+ T 细胞均表现出功能增强的特征。
后续的单细胞转录组测序分析结果也表明肿瘤浸润免疫细胞组成存在显著差异。另外,MICB-vax 诱导的效应 T 细胞和 NK 细胞群向处于高度激活状态的肿瘤细胞有效募集。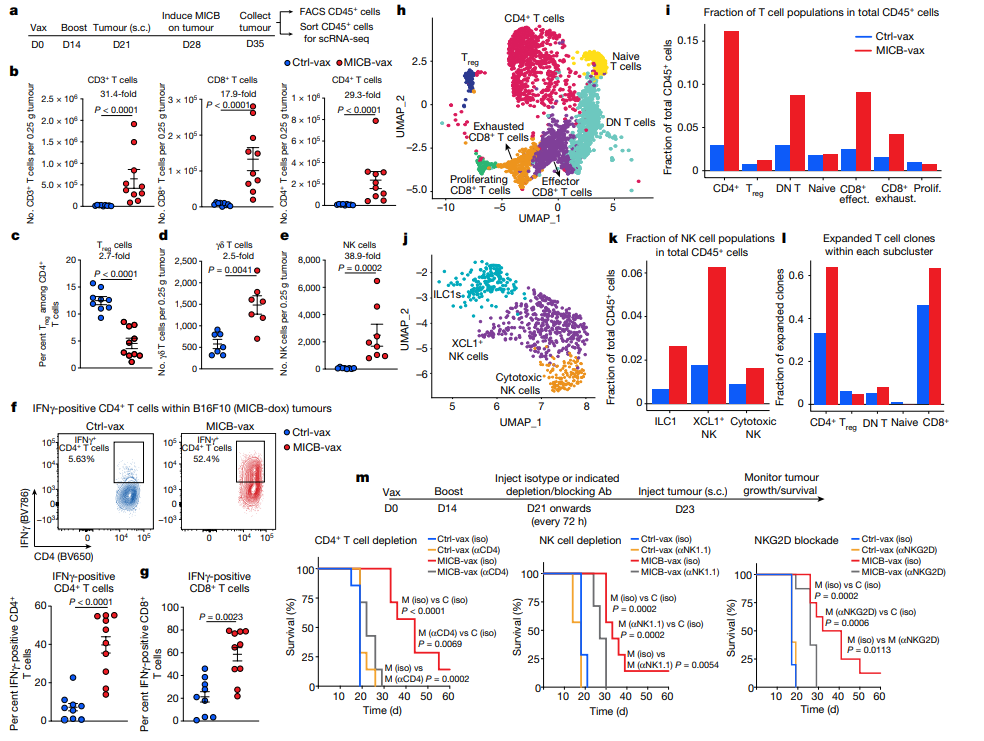
图片来源:Nature
NK 细胞募集的机制探索
随后,他们研究了 CD4+ T 细胞使 NK 细胞和其他效应群招募到肿瘤的机制。他们观察到,与对照组相比,MICB-vax 免疫小鼠的迁移性树突状细胞(DC 细胞)的数量显著增加,而 DC 细胞在运输肿瘤抗原到肿瘤引流淋巴结中发挥重要作用,它们在那里启动抗肿瘤免疫。
利用 Xcr1DTR 小鼠,研究人员评估了 DC 细胞对 NK 细胞招募到肿瘤这一过程中的作用。结果发现,DC 细胞的缺失的确会显著降低 MICB-vax 免疫小鼠瘤内 NK 细胞、CD8+ T 细胞和 CD4+ T 细胞的数量。
借助体外实验,他们还研究了疫苗诱导的抗 MICB 抗体是否能增强 DC 细胞的功能。实验结果表明,与 Ctrl-vax 相比,MICB-vax 免疫小鼠的纯化血清 IgG 显著增强了这些共培养中 CD8+ T 细胞的增殖,抗 MICB 抗体作用下 DC 功能的增强则依赖于 DC 上 Fc 受体的激活。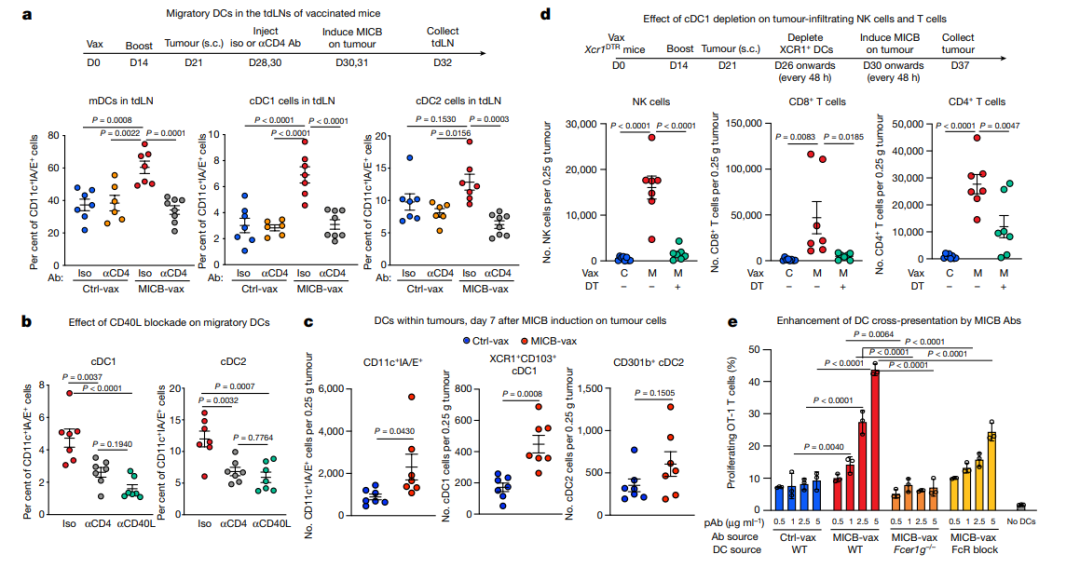
图片来源:Nature
结语
综上所述,本研究报道的新型疫苗通过激活多种效应细胞群(不同的 T 细胞和 NK 细胞群)来实现肿瘤免疫。
机制层面,该疫苗诱导产生的抗体通过抑制肿瘤细胞 MICA/B 的蛋白水解,增强 NK 细胞的细胞毒性功能,还可以增加 DC 细胞将肿瘤抗原递呈给 CD8 + T 细胞。不仅如此,该疫苗还诱导 CD4+和 CD8+ T 细胞对 MICA/B 的反应。总而言之,效应免疫细胞群的参与能够靶向常见的逃逸机制而发挥对肿瘤的保护性免疫。
尽管本研究中所涉及的临床前研究结果均表明该疫苗的安全有效性,不过这种方法还是需要在癌症患者的临床试验中进行合理评估,作者们也在文章中表示目前正在计划进行首次人体临床试验。
同时,该疫苗也可与局部放疗联合使用,因为后者引起的 DNA 损伤也会增强癌细胞 MICA/B 的表达。此外,他们还提到,血清中脱落 MICA/B 水平和肿瘤细胞 MICA/B 的表达也可作为有效的生物标志物对肿瘤患者进行诊断和疗效评估。