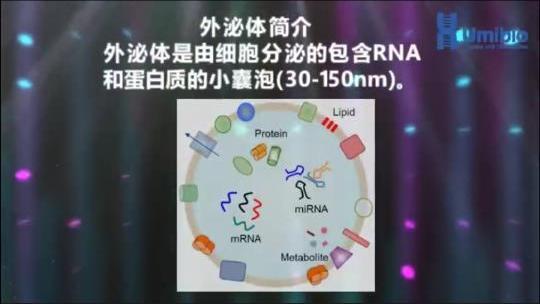
1、外泌体提取纯化试剂盒如何保存?
室温保存(10℃~30℃),无需低温保存。温度过低时 ECS 试剂会出现冻结状态,此时用 65℃ 水浴 1 h 进行解冻即可。
2、外泌体提取纯化试剂盒能否分离纯化 200-1000 nm 直径的囊泡?
不能,本试剂盒不适用于直径大于 200 nm 囊泡的分离。粒径在 200 nm 以上的属于大囊泡,而非外泌体。
3、样品在提取外泌体之前是否可以低温保存?
可以。长期保存请放置于 -80℃,无需加冻存液;短期保存(1-2 天内)则放置于 4℃ 即可。
4、培养细胞时,如何去除血清来源的外泌体?
多数情况下,细胞在体外培养时需要血清,而血清中一般都含有外泌体,为避免血清对细胞外泌体的污染,可采用以下两种方法:
- 将细胞培养用的血清通过 1×105g 超速离心 >10 h 以去除血清外泌体;
- 选择无血清完全替代培养基进行细胞培养。
5、无外泌体血清(或者外泌体专用培养基)在什么时候使用?
- 使用无外泌体血清培养基:细胞在正常含血清的培养基中培养一定的时间后,细胞汇合度在60% - 70% 时,移去原有含血清的培养基,换成新鲜的无外泌体血清培养基,继续培养 24 - 48 h,细胞汇合度达到 80% - 95% 左右时收取上清,该上清液即可用于提取外泌体。
- 使用外泌体专用无血清培养基:
- 待细胞汇合度~50%时,移去原有完全培养基,添加新培养基进行培养,新培养基由 50% 外泌体专用无血清培养基 + 50% 完全培养基组成;
- 待细胞生长汇合度约为70-80%时,移去培养基;
- 使用1×PBS溶液将细胞润洗2-3次;
- 加入外泌体专用无血清培养基继续培养24 - 48 h,待细胞汇合度到 80% - 95% 时收取细胞培养上清液,该上清液即可用于外泌体提取实验。
6、细胞培养过程中的死细胞是否会影响外泌体的提取?
会的。在收获细胞时,应确定死亡细胞占比不超过 5%。细胞凋亡/死亡过程中会释放大量囊泡,它们在外泌体的提取纯化过程中会污染活细胞产生的外泌体,同时易堵塞 EPF 纯化柱。
7、准备做细胞外泌体 Small RNA 的 NGS 测序,初始样品量需要准备多少?
普通肿瘤细胞系推荐使用 50mL 以上的初始样品量。由于某些细胞(如悬浮细胞、干细胞、免疫细胞、神经细胞等)中外泌体含量比较低,建议先通过 10 kD~ 100 kD 的超滤浓缩离心管浓缩 3-5 倍(超滤柱上层液体即为浓缩后的样品),准备 50 mL 以上的浓缩液再使用本试剂盒提取外泌体。
8、细胞上清液的浓缩倍数该如何选定?
由于不同细胞在不同培养条件下外泌体分泌量差异较大,因此针对上清液的浓缩倍数无法给出具体数值。建议先选定一个倍数进行样品浓缩,以外泌体纯化过程中EPF柱堵柱现象作为浓缩倍数是否合适的依据,如果 EPF 柱出现堵柱现象,则可适当降低超滤浓缩倍数。
9、加了 ECS 液离心之后无沉淀,这个现象正常吗?
由于某些细胞(如悬浮细胞、干细胞、免疫细胞、神经细胞等)中外泌体含量比较低,加了 ECS 液离心之后肉眼无法观察到沉淀,在重悬时使用 PBS 需要仔细吹打离心管壁四周和底部(避免剧烈吹打)。针对提取后的外泌体应先进行 NTA 粒径检测或 BCA 蛋白定量检测,再决定是否进行后继实验。
10、在纯化过程中,EPF 柱为什么会出现堵塞现象?
- 可能是因为细胞培养时间过长产生较多细胞碎片(样品离心预处理时不充分,仍有杂质残留)所致。若杂质残留较多(肉眼可见),请将上清液转移至新离心管,10,000 g,10 min离心 2-3 次至无明显沉淀,每次离心收集上清液。
- PBS重悬的外泌体初始液 12,000 g,2 min 离心 2-3 次至无明显沉淀,每次离心收集上清液,上清液再进行EPF柱纯化。
- 建议:细胞培养使用低血清或者无外泌体血清或者外泌体专用无血清培养基,培养时间控制在24 - 48 h 左右 ,收集上清液时培养基颜色正常,不要等到偏黄色时再收集上清液。
11、EPF柱是否可以多次使用?
不能重复使用。过量的样品会超出纯化柱的使用极限,会严重影响分离效果。
12、外泌体如何保存?
纯化后的外泌体可于 4℃ 保存不超过一周,-80℃ 条件下可长期保存。
13、如何鉴定提取的外泌体?
通常会用到:透射电镜检测(形态)、NTA 粒径检测(大小)、Western Blot 检测等方法对提取的外泌体进行鉴定。在进行 Western Blot 检测时,常用的外泌体标志蛋白有CD63、CD9、CD81、TSG101 等。
14、提取的外泌体进行 Western Blot 前是否需要加入 RIPA 试剂裂解?
需要。一般按照 1:1 的比例加入强 RIPA 试剂,或推荐使用外泌体蛋白专用裂解液。
15、进行外泌体 Western Blot 鉴定时有无内参蛋白可供选择?
暂无。目前文献中报道有使用 Actin, GAPDH 作为内参蛋白。
16、进行外泌体鉴定检测时,需要准备多少的初始样品量?
根据 Umibio 实验室的数据统计,进行不同的鉴定检测实验,建议准备相应剂量的初始样品量:
|
样品类型 |
电镜检测 |
NTA检测 |
Western Blot检测 |
|
肿瘤细胞上清液 |
≥20 mL |
≥20 mL |
≥60 mL |
|
原代细胞/干细胞/神经细胞上清液 |
≥40 mL |
≥40 mL |
≥120 mL |
文章来源:宇玫博生物