Cell Reports:浙大蒋晞课题组发文揭示阿片受体激动剂调控白血病表观遗传学修饰的新机制
急性髓系白血病(Acute myeloid leukemia, AML)是最常见的致死性造血系统恶性肿瘤之一,也是成人最常见的急性白血病,具有复杂的基因多样性。AML 的发生率随年龄增长而增长,老年患者预后尤其差。AML 的可选治疗方案十分有限。过去几十年,一线治疗方案主要是非特异性的标准化疗。多种 AML 亚型, 如 MLL 重排的 AML 或 TET2 基因突变的 AML,即使给予化疗,仍常显预后不佳[1]。
近些年人们逐渐认识到,单独讨论基因(遗传学)异常,如基因突变、染色体重构、基因拷贝数异常等,已无法完全解释 AML 复杂的病理表现和预后;而表观遗传学调控则是在遗传学基础上的进一步精细调整。蒋晞研究团队近年的研究发现,这类微调往往能在白血病的发生发展、药物反应等方面起到决定性作用[2-6]。因此,进一步研究表观遗传学调控在白血病中的作用机制,以及开发干预表观遗传调控的治疗白血病的新途径具有重要意义。
TET (Ten-eleven translocation) 家族蛋白 TET1/2/3 可介导 DNA 发生 5-羟甲基胞嘧啶 (5-hydroxymethylcytosine, 5 hmC) 修饰。TET2 作为一个抑癌基因,在 AML 多种亚型中均存在基因突变,其突变率在 AML 中可高达 23%。TET2 突变的 AML 通常预后较差[7]。如能实现 TET2 表达的靶向上调,将有助于为此类 AML 的治疗提供新的思路。
2022 年 1 月 25 日,浙江大学基础医学院/浙江大学医学院附属第一医院蒋晞课题组在 Cell Reports 上发表了题为 Opioid receptor signaling suppresses leukemia through both catalytic and non-catalytic functions of TET2 的研究论文。该研究报道以洛哌丁胺(易蒙停)为代表的阿片受体激动剂在急性髓细胞性白血病(Acute myeloid leukemia, AML)中的潜在疗效,及其调控 TET 介导的 DNA 修饰的分子机制及信号通路。
为了明确 AML 发病过程中涉及到的信号转导通路,作者对细胞表面最大的受体超家族(G protein-coupled receptors (GPCRs))的激动剂和拮抗剂进行了小分子化合物筛选,发现阿片受体激动剂洛哌丁胺 (OPA1) 对多种 AML 细胞活性的抑制作用最为显著。
为了进一步研究 OPA1 在体治疗效果,作者建立了两种小鼠白血病模型和异源性骨髓移植(patient derived xeno-BMT (PDX))模型。发现上述模型中,腹腔注射 OPA1 都可以显著延长并改善白血病小鼠生存。因 OPA1 是一种常用口服止泻药,作者尝试了灌胃给药;结果表明:口服 OPA1 也能起到比较明显的疗效。
已有研究报道,阿片类药物与 DNA 甲基化相关[8, 9]。作者检测发现在 OPA1 处理的 THP-1 细胞和 MA9.3-RAS 细胞中 DNA 甲基化(5mC)未发生明显变化,而羟甲基化(5 hmC)水平增加。OPRM1 激动剂,特别是 OPA1,显著增加 TET2 表达水平,而阿片受体拮抗剂则抑制 TET2 的表达。
阿片受体信号通路激活可活化下游转录因子 CREB, EGR1, CEBPB, TP53 等的转录活性[10-13]。通过 ChIP-QPCR 实验,作者发现 OPA1 处理使上述转录因子与 TET2 基因启动子区域结合增加。敲除或敲降 EGR1 可显著抑制 TET2 表达,降低 AML 细胞对 OPA1 的敏感性;过表达 EGR1 能够增加 OPA1 的敏感性。以上结果提示阿片受体信号通路可能通过活化 EGR1,从转录水平上调 TET2。
为了探索 TET2 下游的调控通路,作者对 OPA1 或 DMSO 处理的 THP-1 细胞进行了 5 hmC 测序和转录组测序。结果分析发现:OPA1 处理使 NF-κB 信号通路富集,通路重要调节因子 TRAF2,BLNK,RIPK1 等表达水平明显升高。OPA1 处理后,TRAF2 的转录起始位点(transcriptional start site (TSS))区域检测到明显的 5 hmC 富集,提示 TRAF2 可能是 OPA1 诱导 DNA 5 hmC 修饰的靶基因。
进一步,作者通过 ChIP-Q-PCR、双荧光报告基因等实验,证实了 TET2 对 TRAF2 的转录激活作用。敲降 TRAF2,可显著抑制 OPA1 对 AML 细胞活性的杀伤作用。以上结果提示:AML 细胞中可能存在 OPRM1-EGR1-TET2-TRAF2 这一调节通路。
更进一步,作者针对 TET2 在介导 AML 对 OPA1 的药物反应中所扮演的角色进行了深入探讨。首先,体外和体内实验证明 TET2/Tet2 基因敲降或敲除显著降低 AML 细胞对 OPA1 的敏感性,所以 TET2 的表达对 OPA1 疗效起决定作用。同时,作者检测了一系列 AML 病人原代骨髓细胞对 OPA1 的敏感性,发现带有 TET2 突变和不带 TET2 突变的 AML 细胞均可被 OPA1 抑制细胞活性。
作者进一步构建了 TET2 表达载体、负显性突变体以及在 AML 病人中发现的片段缺失突变体,发现在对 OPA1 不敏感的 Tet2 敲除 AML 细胞中,过表达上述任一基因均可引起不同程度的敏化。以上结果提示:AML 细胞对 OPA1 的反应主要依赖于 TET2 的表达,仅部分依赖于 TET2 的催化活性。
为了探寻 TET2 的活性非依赖调控机制,作者研究了 TET2 与其结合蛋白 OGT 的关系。结果表明,OPA1 处理能显著增强 TET2 与 OGT 的相互作用,并增加 TET2 和 OGT 在其共同靶基因(如 DNMT3B)启动子区的富集,活化基因转录。
最后,作者通过体内、外实验证明 OPA1 与临床一线标准化疗药阿糖胞苷(Ara-C)、阿霉素(DNR)具有协同作用。在 Ara-C 耐药的 AML 细胞中,OPA1 也表现出较好的细胞活性抑制,这可能与 Ara-C 耐药细胞中上调的 TET2 表达有关。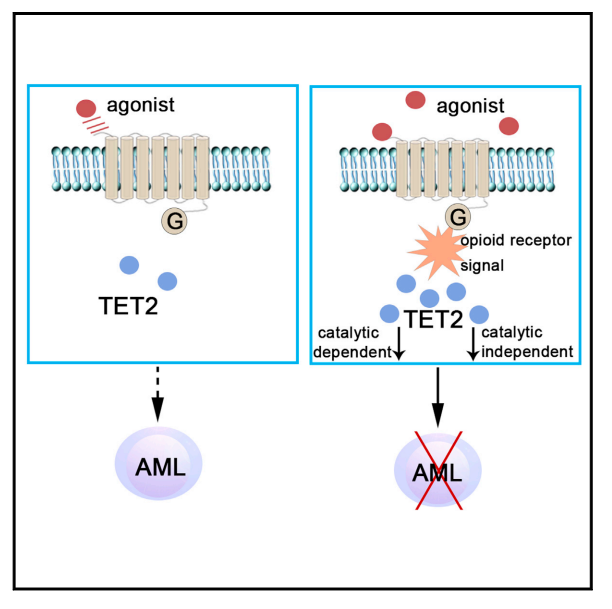
图片来源:Cell Reports
综上所述,这项研究首次发现并系统报道了阿片受体激动剂对 AML 的潜在疗效,揭示了阿片受体信号通路对 TET 介导的表观遗传学修饰的全新调控,阐释了 TET 在阿片受体激动剂治疗过程中表现出的激酶活性依赖和非依赖的双重功能,提示以洛哌丁胺为代表的阿片受体激动剂「老药新用」治疗白血病、以及具有类似机制的其他肿瘤的可能性。
![]()










