流式课堂 | 裂红 or 分离液?外周血不同制备方法应用场景
Elabscience
外周血样本采集完毕后,我们需要对其中的待测单细胞进行提取。针对外周血样本,最常使用的样本制备方法有两种:
一. 裂红法
利用红细胞裂解液,去除红细胞
二. Ficoll 法
利用不同细胞的沉降系数差异,进行梯度密度离心,提取 PBMC
两种方法分别在什么场景下应用?接着往下看。
裂红法
裂红法,即裂解样本中的红细胞。血液中的红细胞比白细胞多 10-100 倍,红细胞数量过多,会影响细胞群体的分析。因此,我们在做血液样本检测时,经常需要裂解红细胞。
裂红前
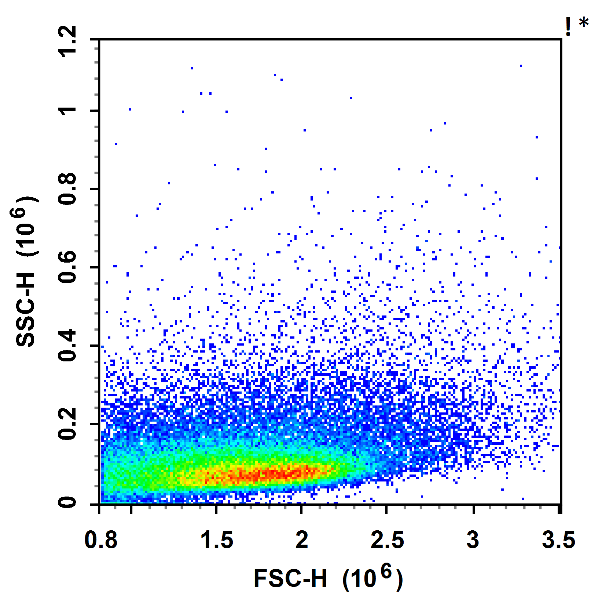
裂红后
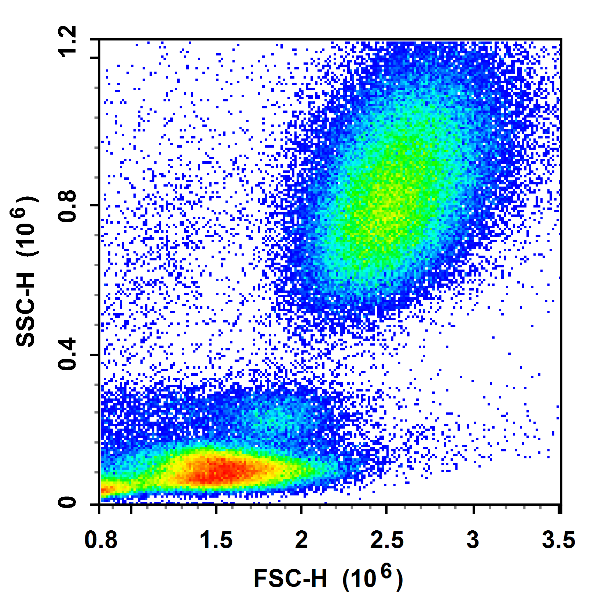
01 原理
红细胞表面有专属的表面抗原,当裂解液中含有可以攻击特定红细胞表面抗原的酶,就只会造成红细胞的变形、膨胀、裂解。
02 优点
⊙ 各类型白细胞(淋巴细胞、单核细胞、粒细胞等)保存完整
⊙ 得率高
⊙ 步骤简单,10min 即可
03 缺点
⊙ 对裂红时间要求较高,过长或过短均会影响结果
⊙ 细胞活性低于 Ficoll 法
04 使用注意事项
⊙ 裂解时间过长,也会对其它细胞造成损伤,所以要把握好裂解的时间;
⊙ 做流式检测时,并非所有的血液样本都需要裂红。倘若需要检测的是白细胞(如淋巴、单核、粒细胞等),需要裂解红细胞;倘若检测的是红细胞,不需要裂解红细胞;
⊙ 如果后续样本不用于流式分析,而是需要培养或者冻存复苏,使用裂红后培养的细胞,活性可能会打折扣。
Ficoll 密度梯度离心法
01 原理
根据细胞的沉降系数差异,借助细胞分离液和离心操作,对细胞进行分离。
02 优点
⊙ 获得的细胞更纯净,有利于细胞培养后检测胞内因子
⊙ 可将细胞冻存后再复苏、培养、检测
⊙ 去除死细胞
03 缺点
⊙ 步骤复杂,需 30min 以上
⊙ 取白膜层需要丰富的经验
⊙ 只能获得淋巴细胞和单核细胞,会丢失一部分稀有细胞
⊙ 可能会引起细胞受体激活
分离前
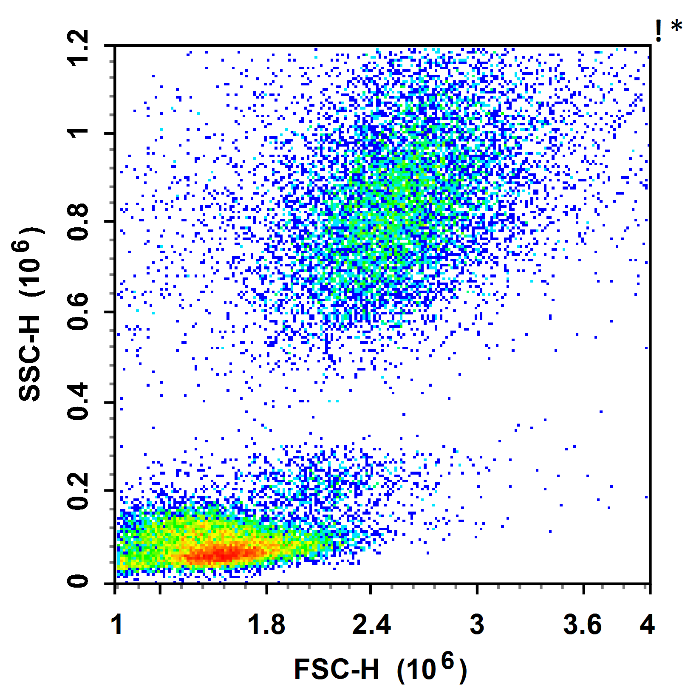
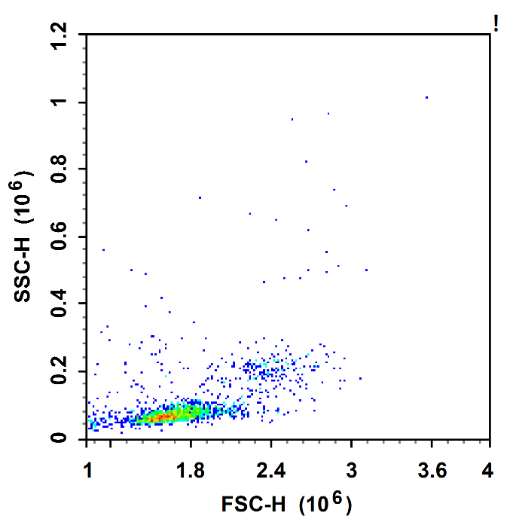
总 结
• 如研究对象是淋巴细胞、单核细胞或粒细胞,且细胞不需要进行培养或冻存,仅进行流式分析时,建议使用裂红法制备外周血样本;
• 如研究对象是淋巴细胞亚群或单核细胞,在做以下实验时,建议使用 Ficoll 法提取 PBMC:
(1)获得的细胞需要继续培养、刺激、阻断或冻存;
(2)研究单核细胞。因为单核细胞只占白细胞的 3-10%,如果使用裂红法,会发现细胞群体太少。为了保证充足的样本量,需要使用 Ficoll 法。