施一公团队突破性进展再登 Science!以超高分辨率解析核孔复合物的结构细节
生物学霸
非洲爪蟾(Xenopus laevis)作为一种经典的脊椎动物模型,其胚胎发育过程与人类器官形成过程相似,被广泛地应用于 DNA 损伤应答、细胞凋亡、免疫和炎症反应以及再生和可塑性的研究。
真核生物的细胞核由双层的核膜(NE)包裹,核孔复合物(NPC)在核膜中形成一个通道,用于在细胞质和细胞核之间选择性交换大分子。NPC 是具有 8 倍对称性的圆柱形组件,其组成部分与许多人类疾病有关,包括癌症、病毒感染等。NPC 是真核细胞中最庞大,最复杂的分子机器之一,将 NPC 中的许多蛋白质组装成正确的三维分子结构一直是一个巨大的挑战。
2022 年 6 月 10 日,西湖大学施一公团队在 Science 杂志发表研究论文 Structure of the cytoplasmic ring of the Xenopus laevis nuclear pore complex。
该研究聚焦于非洲爪蟾核孔复合物(NPC)结构,首次扩展了脊椎动物细胞质环(CR)亚单位复合体模型的分子量,获得高分辨率的单粒子冷冻电镜显微结构。除了解析 Y 复合物,同时发现 5 个核孔蛋白 Nup358、2 个 Nup205 和 2 个 Nup93 构成了 CR 的关键组分,揭示了 CR 核孔蛋白间的界面,为展示 NPC 的精细分子结构是如何设计和组装,探索 NPC 的功能和病理过程提供了新的视角!
图 1:来源 Science
核孔复合物的前生今世
核孔复合物(NPC)作为分子量巨大的细胞机器之一,由细胞质丝、细胞质环(CR)、内环(IR)、核环(NR)、核篮(NB)和腔环(LR)组成,其分子量高达 100MDa,因此如何克服技术障碍获取其精细结构,了解其作用机制一直是结构生物学家们的关注点。
在过去二十年中,结构生物学家们将单个核孔蛋白和亚复合体的 X 射线结构与低温电子断层成像重建相结合的综合建模,逐步地增进了人们对 NPC 的了解。
本研究利用单粒子冷冻电子显微镜(cryo-EM)对非洲爪蟾卵母细胞中的 NPC 结构进行探索,结合以往的研究结果,加强了蛋白样品制备,优化冷冻电镜图片的采集,并开发出有效的数据处理策略,获得高分辨率的 NPC 结构。
该结构的核心和 Nup358 区域的平均分辨率分别提高到 3.7Å和 4.7Å,其中核心区域的最高局部分辨率达到 3.3Å。此外,该蛋白结构的 N 端 α-螺旋结构域 Nup358 部分,其分辨率高达 3.0Å。
这无疑是一个振奋人心的研究结构,如此庞大的核孔复合物具有如此之高的分辨率,为了解 NPC 的精细结构打了一剂强心针。
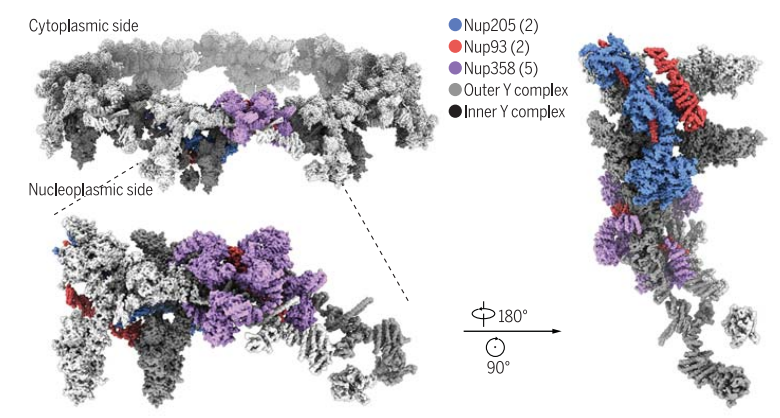
图 2:非洲爪蟾核孔蛋白的细胞质环总体结构示意图
核孔复合物的组装细节
细节决定成败,天下大事必做于细。在结构生物学领域研究中,获得精细的结构便是成功了一半。
当获得了高分辨率的非洲爪蟾 NPC 结构后,发现每个 CR 亚单位具有两个 Y 形多组分复合物,称为内 Y 复合物和外 Y 复合物。CR 中的 16 个 Y 复合体,8 个内部和 8 个外部 Y 复合体,以头到尾的方式组装,以近端和远端同心的形式构建支架。Y 复合体由短臂(Nup85、Nup43 和 Seh1)、长臂(Nup160 和 Nup37)和茎(Nup96、Sec13、Nup107 和 Nup133)组成。
随后,本研究继续将步伐迈向了探索其细节的过程,鉴定了 Nup358、Nup205 和 Nup93 是 CR 支架的组成部分,CR 亚单位模型包含 30 个核孔蛋白中的 19037 个氨基酸。
令人惊讶的是,Nup160 的短臂、长臂分别和 Y 复合体的茎相交。两个相互不接触的 Nup205 利用构象弹性,通过不连续的界面,分别结合内部和外部 Y 复合体。两个 Nup93 均包含一个 N 末端延伸的螺旋和一个 ACE1 结构域,桥接 Y 复合物和 Nup205。Nup93 和 Nup205 共同负责着相邻 CR 亚单位之间的接触作用。五个 Nup358 分子,每个分子的形状形似虾尾巴,因此获名「钳子」,参与维持 NPC 结构的稳定组装。
总之,Nup358,Nup205 和 Nup93 是形成 CR 的关键结构组分,为解释 NPC 在细胞周期中会进行组装和拆卸的机制提供了充分的证据!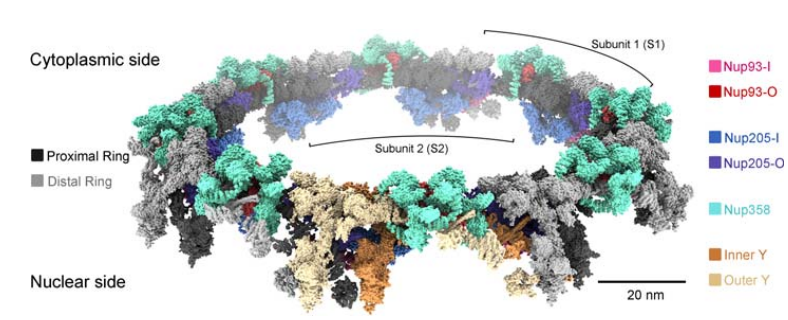
图 3:来源 Science
持久且深入的核孔复合物研究
早在 2020 年,施一公团队便将目光投向非洲爪蟾的核孔复合物研究领域,克服巨大的技术障碍,逐步揭开核孔复合物的神秘面纱,从初步确认整体结构再到深入地刻画复合物细节,为研究核孔复合物画上浓墨重彩的一笔!
2020 年 5 月 4 日,施一公团队 (西湖大学为第一单位) 在 Cell Research 杂志发表研究论文 Molecular architecture of the luminal ring of the Xenopus laevis nuclear pore complex,该研究报告了非洲爪蟾卵母细胞的 NPC 的腔环(LR)的冷冻电子断层扫描(cryo-ET)结构。通过单粒子低温电子显微镜(cryo-EM)分析独立确认 LR 的关键结构特征,该研究首次揭示了 LR 以前未知的特征,为解释 NPC 的弹性提供了直观的基础。
图片来源:Cell Research
与此同时,施一公团队(清华大学为第一单位)对非洲爪蟾的核孔复合物的组装和工作细节进行了更为细致的探索,2020 年 5 月 6 日在 Cell Research 杂志发表研究论文 Structure of the cytoplasmic ring of the Xenopus laevis nuclear pore complex by cryo-electron microscopy single particle analysis。
该研究解析了非洲爪蟾 NPC 的胞质环(CR)的单粒子冷冻电子显微镜结构,其整体结构平均分辨率为 5.5Å,包含 Nup358 区域 7.1 Å,Nup214 区域 7.9 Å,局部分辨率达 4.5 Å。在如此高分辨率下,更加清晰准确地将基本的蛋白二级结构和大部分的 CR 组分修入模型当中。
图片来源:Cell Research
2022 年 2 月 17 日,施一公团队在 Cell Research 在线发表题为 Cryo-EM structure of the nuclear ring from Xenopus laevis nuclear pore complex 的研究论文,该研究展示了非洲爪蟾 NPC 核质环(NR)亚基的单粒子冷冻电镜结构,平均分辨率为 5.6 Å。
该研究阐释了 NR 的基本构成,并结合团队之前对 NPC 中胞质环(CR)和内环(IR)的结构研究,搭建了当时最详细、最精确的 NPC 支架结构模型,为领域内理解脊椎动物 NPC 的组成、结构、组装以及功能提供了坚实的基础。
图片来源:Cell Research
同年 3 月 18 日,施一公团队在 Cell Research 在线发表了题为 Cryo-EM structure of the inner ring from the Xenopus laevis nuclear pore complex 的研究论文,展示了非洲爪蟾 NPC 内环 (IR) 亚基的单粒子冷冻电子显微镜结构,平均分辨率为 4.2 Å,揭示了脊椎动物 NPC IR 亚基组装的分子基础。
图片来源:Cell Research
冷冻电镜作为引爆生物学进入新时代的工具,在结构生物学领域发展中立下了汗马功劳,让我们继续翘首以盼,等待更多的超大分子量和高分辨率的蛋白结构诞生,见证实验结构生物学的革命!