如何获得高质量的细胞上清液外泌体?
宇玫博
第一步细胞培养:外泌体来自于细胞,必须先从源头抓起,高质量的细胞及上清液产出高质量的外泌体。
收集上清的细胞培养原则:在细胞健康正常生长的前提下,尽可能的减少血清外泌体或是不使用血清。
|
培养条件 |
优点 |
缺点 |
||
| 1 |
含血清的完全培养基 |
✘ |
|
血清中含有大量异源外泌体 |
| 2 |
含去外泌体血清的培养基 |
✔ |
营养相对丰富 |
去外泌体血清难以做到 100% 的去除的,因此即使 1% 的血清外泌体残留也带来大量的异源外泌体 |
| 3 |
基础培养基(DMEM、1640、F12 等) |
✘ |
|
此种培养条件细胞处于饥饿状态,会将培养基中的营养物质(包括外泌体)全部消耗掉的,上清液中的外泌体含量低。 |
| 4 |
✔ |
不含异源外泌体 |
常见的肿瘤细胞培养通常都可以维持生长,而那些血清培养都困难的细胞就难以通用了,需要通过预实验摸索。 |
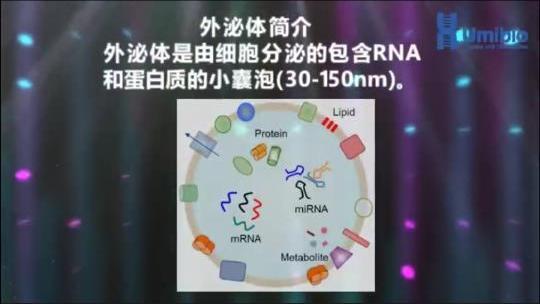
第二步细胞上清液预处理:获得高质量外泌体预处理也很重要。细胞上清液中有什么物质?除了我们感兴趣的外泌体外,还有少量细胞、细胞碎片、游离蛋白、脂类等。需要做的就是通过差速离心尽可能的去除一些杂质物,先用 800 ~ 1000g 左右的离心力 10 分钟有效去除细胞残留,取上清后,再 8000 ~ 10000g 离心 10 分钟有效去除细胞碎片物,这时候的上清液就可以进行保存了。短期 3 ~ 4 天左右使用的话,则可以放到 4℃ 的冰箱中,而长期个把月后使用的话,则在 -80℃ 进行保存,使用前取出来 4℃ 自然融化即可。那么这些离心操作是否可以不做呢?不可以的。细胞上清液处理的越早越好,处理晚时存留细胞会坏死而破碎,更多的胞内囊泡就会释放出来了,这时候的样品就更加的复杂了,更不利于后期的研究了。
第三步初步浓缩(也可省略此步):是不是在提取干细胞上清外泌体过程中会有看不到沉淀的时候?这时心中就没了谱,下游的检测项目做的更是提心吊胆。因此,在这里给出了通过超滤方法进行浓缩处理的建议。超滤的原理就是利用一定的尺寸大小的滤膜拦住大颗粒物而放过小颗粒物的原理,在离心管中最终呈现上液和下液,我们在根据实验目的各取所需。针对细胞上清液的特点,建议可以使用 10 KD ~ 100 KD 之间的超滤管来进行样品浓缩,外泌体通常是在超滤离心管的上室中,浓缩倍数控制到 5 倍左右;针对干细胞、神经细胞等可以将浓缩倍数提升到 10 倍左右,因为这些细胞外泌体分泌量相对肿瘤细胞来说要少很多。
第四步外泌体提取:
|
方法 |
优点 |
缺点 |
|
超速离心法 |
提取量相对较大 一法适用多类样品 成本较低 |
操作复杂度高 耗时长 因离心管材质量高低,管壁吸附损失程度不同 同时检测的样品数量有限 需要超速离心机 |
|
外泌体提取试剂盒 |
操作简单 耗时较短 不需超速离心机 纯度较超速离心法高 |
单次处理体积偏小 |
文章来源:宇玫博生物