冷冻 23 年的睾丸组织,仍能产生有活力的精子!新研究为这些患者带来福音……
生物学霸

图片来源:PLOS Biology
研究内容
为了评估冷冻保存的精原干细胞产生精子的潜力,研究人员将冷冻 23 年以上的 SSC 与短期冻存(1 到 4 个月)的 SSC 以及新鲜获取的 SSC 移植到已去除内源性生殖细胞的裸鼠当中,并进行了比较。结果显示,所有处理都能产生精子形成的克隆,但长期冷冻的 SSC 所形成的细胞克隆数量明显低于短期冷冻或新鲜的细胞样品。
对移植后克隆的组织学分析显示所有处理组中都包含成功形成精子所需的全部生殖细胞类型,包括伸长的精子细胞。虽然长期冷冻细胞移植的睾丸中含有精子,表明精子形成已完成,但未观察到有可见管腔、组织良好的精管,伸长的精子细胞比例显著降低。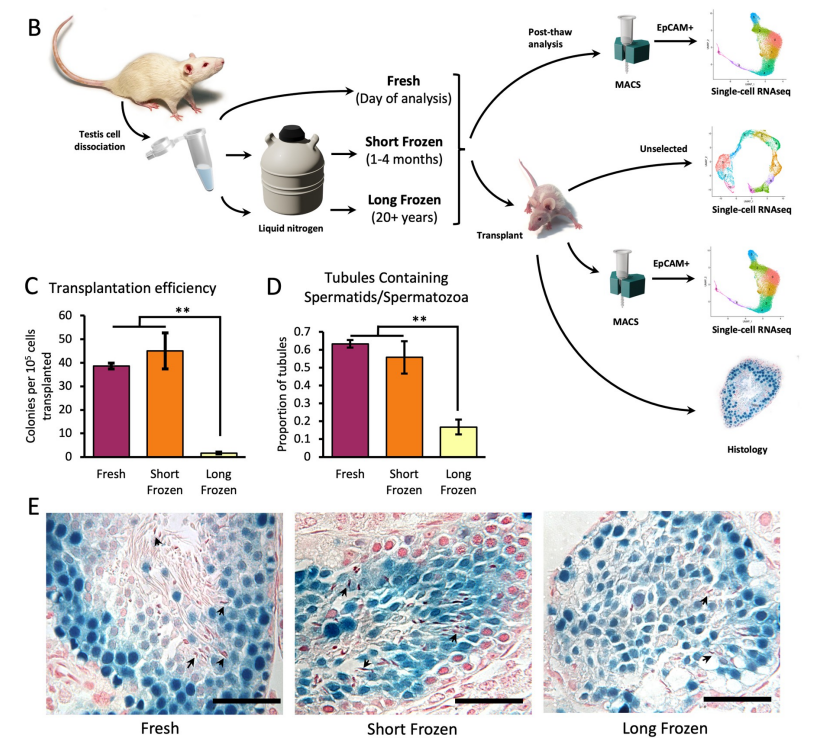
图片来源:PLOS Biology
由于冷冻后移植的细胞是未来治疗应用的基础,研究人员重点研究了冷冻对 SSC 的影响。他们评估了不同处理间干细胞的转录组差异,发现新鲜样品与冷冻样品相比存在显著差异,短期冷冻细胞与长期冷冻细胞之间没有明显差别。
但与新鲜样品相比,长期冷冻细胞显示出更显著的转录差异。与这些数据一致的是,通路分析显示,与短期冷冻相比,在长期冷冻的细胞中,受到冷冻影响的相关通路往往受到更显著的干扰。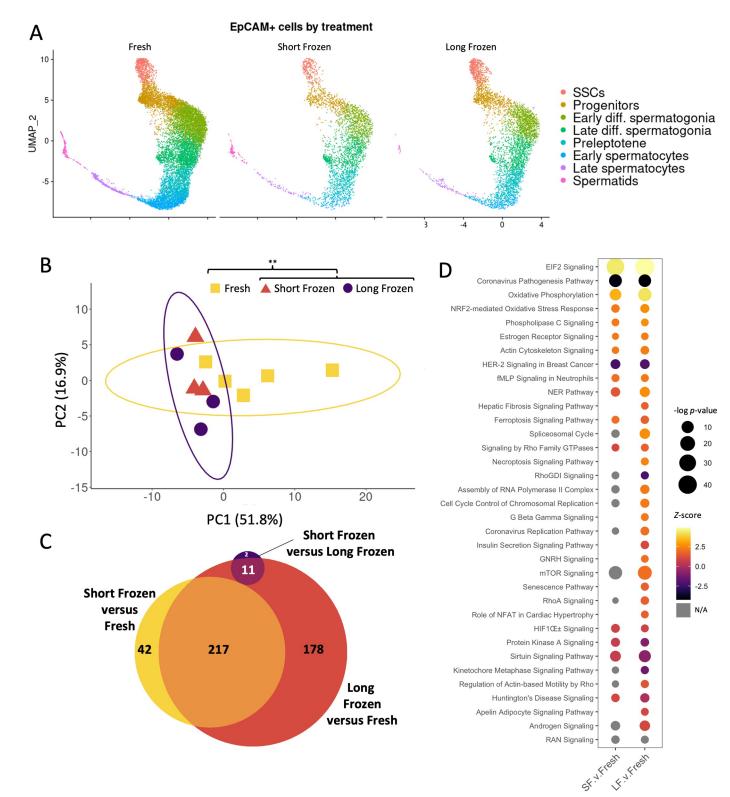
图片来源:PLOS Biology
随后,他们对移植后的细胞进行了单细胞 RNA 测序。三种移植处理的分析结果都显示了大鼠全部生殖细胞的分布,表明均存在精子发生的所有阶段。然而,移植的大鼠细胞转录组与原生环境的细胞相比仍存在一些差异。显著的干扰通路主要集中在减数分裂前阶段,包括氧化磷酸化、氧化应激反应和 DNA 损伤反应的变化。
与新鲜细胞相比,短期冷冻细胞和长期冷冻细胞之间的基因表达变化相似。长期冷冻的样品在未分化的精子中显示出增强的干细胞信号传导,并且圆形精子细胞较少。对长期冷冻和短期冷冻的 DEGs 进行细胞类型特异性通路分析显示,SSC 群体中最显著的变化包括经典的 SSC 自我更新通路,如 GDNF 家族配体受体相互作用、MAPK 信号通路和癌症信号通路上调。
在不同处理组中,两个表达差异最显著的基因是 Prm1 和 Tnp1。这些基因在圆形精子细胞中表现出高度显著的差异,Prm1 在新鲜移植和短冷冻中分别比移植长冷冻高 2.0 倍和 2.3 倍。同样,Tnp1 在移植短冷冻中比移植长冷冻中表达高 1.7 倍,在新鲜移植中表达高 2.1 倍。移植后,长期冷冻的样本显示完全分化的能力下降,显示了显著富集的干细胞群和增强的干细胞信号。与短期冷冻样品相比,长期冷冻的圆形精子细胞表达的关键染色质重塑基因较少,其次是伸长的精子细胞显著损失。

图片来源:PLOS Biology
综上,这项研究确定了睾丸组织在长期冷冻保存的再生潜力,同时揭示了长期冷冻对睾丸组织移植的持续影响。与仅短暂冷冻的组织相比,冷冻的时间延长带来了生育能力下降的代价。这提示在未来的研究中,需要关注 SSC 生存能力的时间依赖性退化,以及确定并减轻在冷冻过程中损害细胞生存能力的关键因素,以改善青春期前罹患癌症男孩的生殖选择。
据 2020 年的一项调查性研究,在美国和以色列等地区已出现了帮助男孩冷冻睾丸组织的机构,冷冻者的平均年龄是 7.9 岁,睾丸的计划保存时间从 5 个月到 34 年不等。研究人员 Whelan 表示:「我们的研究表明,大鼠精原干细胞可以冷冻 20 多年,移植到不育的受体动物中并再生产生精子,尽管速度降低。这可以提供一种方法来恢复接受癌症治疗的青春期前男孩的生育能力损失。」