只需这四步!多重荧光免疫组化方法建立
Akoya
越来越多的证据表明多重荧光免疫组化 (multiplex immunohistochemistry, mIHC),又称多重免疫荧光 (multiplex immunofluorescence, mIF) 技术的稳健性和预测价值。利用多重荧光免疫组化(mIHC)/ 多重免疫荧光(mIF)进行多重成像的空间生物标志物分析有望在发现研究和临床阶段的研究中得到广泛采用。
越来越多的实验室报道正在使用 Opal 多重荧光免疫组化优化为可重复的工作流程,为该技术的稳健性和预测价值提供了很多证据。我们在这里介绍收集到的一些经验和最佳实践,建立可重复的工作流程的四个关键步骤,包括抗体组合开发、染色、图像采集和分析,可节省研究人员的时间,并最终提高药物发现和开发的效率。
1. 建立最佳抗体组合
使用 Opal 多重荧光免疫组化工作流程准确、可重复地鉴定组织中的不同细胞群及其关系,需要仔细设计、开发和优化用于多重生物标志物定量的抗体组合[1]。
a 从预先设计的抗体组合开始
要选择在多重荧光免疫组化中具有高灵敏度、特异性、再现性和优异性能的可识别所需靶标的抗体似乎并不那么容易。市面上可提供一些商品化的预先设计、优化的抗体组合试剂盒。这些试剂盒通过提供识别关键免疫和/或肿瘤细胞标志物的优化一抗组合,为新用户提供了构建多重荧光免疫组化抗体组合的简便途径。而开放渠道使研究人员能够灵活地添加他们自由选择的其他标志物。
b 选择抗体
与免疫学家和疾病专家合作,确定理想的一系列生物标志物可以回答手头的生物学问题。哪些标志物可以明确区分靶细胞表型与周围组织?是否有特定的标志物,其空间分布对于研究是否很重要?相关生物学问题是否涉及标志物的共定位和/或复杂细胞表型的相互作用?这些都是在我们选择抗体前需要思考的问题。
如果手头已经有一种可用于传统免疫组化(IHC)的抗体,可以从这些抗体入手。而抗体搜索引擎(例如 CiteAb)是发现所需标志物抗体的下一步工具。搜索引擎可以帮助识别具有最完整验证数据和引文支持性能的抗体信息。咨询病理学家和检测专家,进一步了解所选抗体是否适合多重荧光免疫组化。对于多重荧光免疫组化检测方法,单克隆抗体通常能提供更低的背景信号、更高的特异性和更低的批次差异[2]。
c 使用对照组织验证所选择的抗体组合
选择正确的阳性和阴性对照组织样品对于开发信息丰富的多重荧光免疫组化检测方法至关重要。同样,与免疫学家和疾病专家合作可以帮助识别和寻找这些组织。通过在阳性和阴性细胞系、细胞沉淀和组织对照上测试单个抗体,建立初步抗体特异性。初始检查可使用更高通量的免疫测定方法,例如蛋白印迹或免疫组化(IHC)。通过检测一系列正常和病患组织进一步建立特异性[2]。
对作为感兴趣的靶标同一蛋白家族中的其他蛋白进行正交验证和抗体交叉反应测试可帮助识别抗体直接效果。通过测试在不同表达水平目标靶标的细胞系来建立抗体敏感性。有时,通过抗体克隆池(通常具有非重叠表位)可提高敏感性。最后,通过确定由多个操作人员和/或使用不同抗体批次进行的研究是否提供可比较的结果来确定可重复性[1]。
2. 多重荧光免疫组化检测方法的开发和优化
a 首先使用单标免疫组化和免疫荧光优化
首先开发单标测定,以初步了解染色参数,包括组织处理/固定参数、抗原检索条件( pH 值和温度)、基于已知阳性对照的亚细胞定位和染色模式、抗体和检测试剂滴定以及其他孵育和封闭条件。单标免疫组化是此步骤的首选起始方法,除非用户以前具有免疫荧光(IF)的经验[2]。
建立 IHC 显色方案后,使用单标 IHC 和 Opal 染色检测工作流程开展单标抗体优化,以验证 IHC 显色与阳性和阴性组织的染色结果是否相似。然后采用IF方法,使用与优化的 IHC 方法相同的抗体稀释度。而 IF 的选择是将最亮的荧光信号与表达最弱的生物标志物配对使用,反之亦然,因此可能需要根据所选的荧光信号进一步优化抗体浓度。除了所需的肿瘤样本外,人扁桃体通常还用作免疫肿瘤学IF优化的组织质控样本,以设置抗体的阈值并揭示任何差异或背景染色问题。
b 多重荧光免疫组化(mIHC)的优化
首先,确定多重荧光免疫组化(mIHC)抗体组合的染色顺序。确定染色顺序时要考虑的关键因素包括生物标志物的丰度,抗原修复以及表位承受热介导的洗脱循环的能力(图 1)。染色顺序应尽量减少伞形效应,即与前面的标记物结合的酪胺在空间上阻碍了对同一区域抗原的识别。从浓度最低的抗体(最丰富的抗原)开始顺序染色,以浓度最高的抗体结束,可在一定程度上避免伞形效应。通过将结果与 IHC 或单标 IF 进行比较,验证正确的染色顺序。通过增加一抗浓度、降低荧光浓度或改变抗体的染色顺序,都可降低伞形效应。
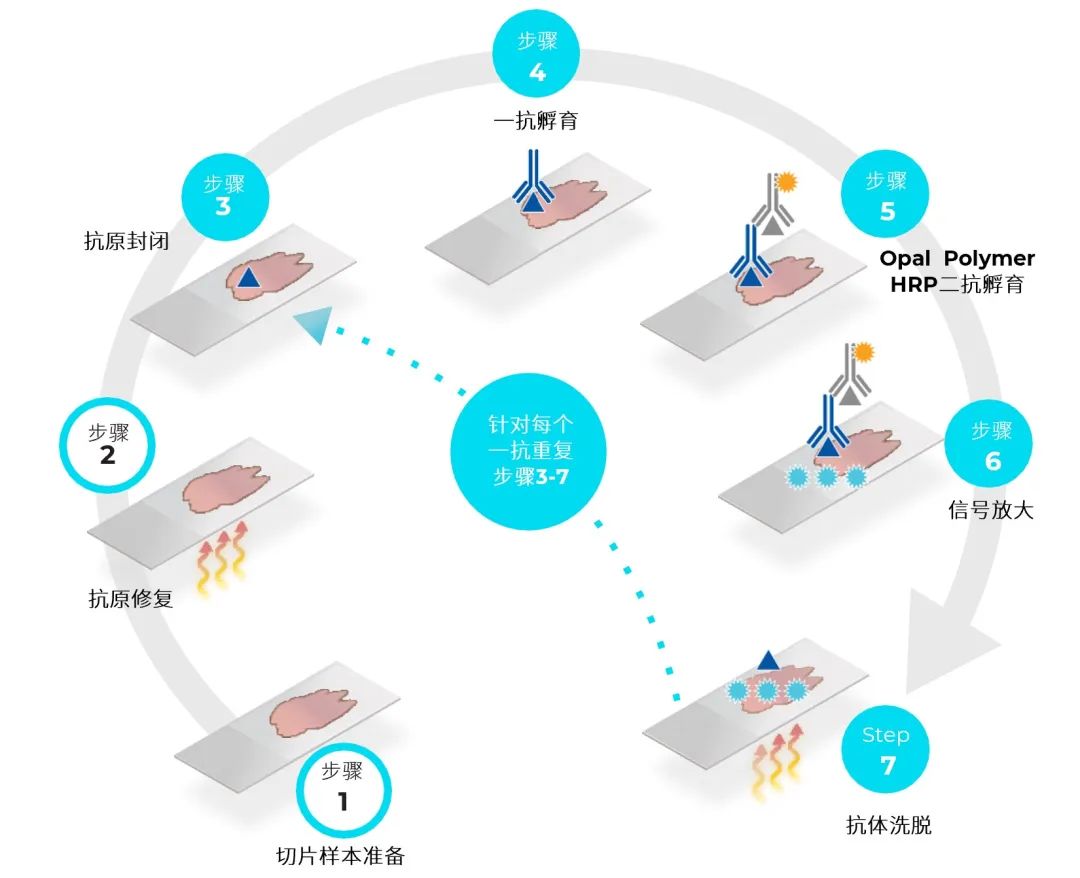 图1. Opal 多重荧光免疫组化检测基于传统IHC染色流程
图1. Opal 多重荧光免疫组化检测基于传统IHC染色流程
有时,当一种抗体的信号出现在另一个的检测通道中会显示出抗体串扰。此外,许多组织本身有自发荧光,这种自发荧光会混淆对低表达生物标志物的准确检测,并可能引入错误的信号强度。改变抗体的染色顺序或增加与引起干扰的抗体相对应的抗原修复步骤的时间, 都可减少串扰和干扰的发生[3]。
使用具备光谱拆分的多光谱成像系统,如 Akoya Biosciences PhenoImager 解决方案可以将自发荧光拆分到单独的通道中,并有效拆分感兴趣的每个生物标志物信号来克服这些问题,从而不用担心强度或光谱如何重叠的问题。
3. 图像采集和数据分析
a 选择多重荧光免疫组化(mIHC)成像仪器
整张切片的全组织成像越来越被认为是最可靠的成像方法[6]。由于组织表现出显著的细胞和空间异质性,特别是 PD-L1、CD8 等免疫标志物,因此需要对整张肿瘤组织切片进行高分辨率多重分析,而不是像传统方法仅分析感兴趣的区域(ROI)。在疾病特异性生物标志物的评估中,仅对 ROI 分析往往会引入显著偏差、人为偏见甚至错误。
整合的多重荧光免疫组化系统,如 PhenoImager 空间表型分析解决方案(图2),可实现多重靶标与图像分析结合,对整张组织片进行高分辨率分析。

图2. Akoya Biosciences多光谱成像系统,左边为 PhenoImager HT,右边为 PhenoImager Fusion
选择成像系统的标准可考虑以下几点:
-
光谱范围
-
分辨率
-
全片成像速度和通量
-
自动化程度
-
多重靶标数量
b 开发图像分析方法
图像采集后,将图像文件导入分析软件如 inForm,并使用适当的光谱库以光谱拆分图像(图3)。拆分后的图像可使用 inForm 软件或其他图像分析软件进一步分析。该软件包含用户可训练的方案,可使用机器算法自动检测和执行组织分割,细胞核/细胞分割和细胞表型分析。
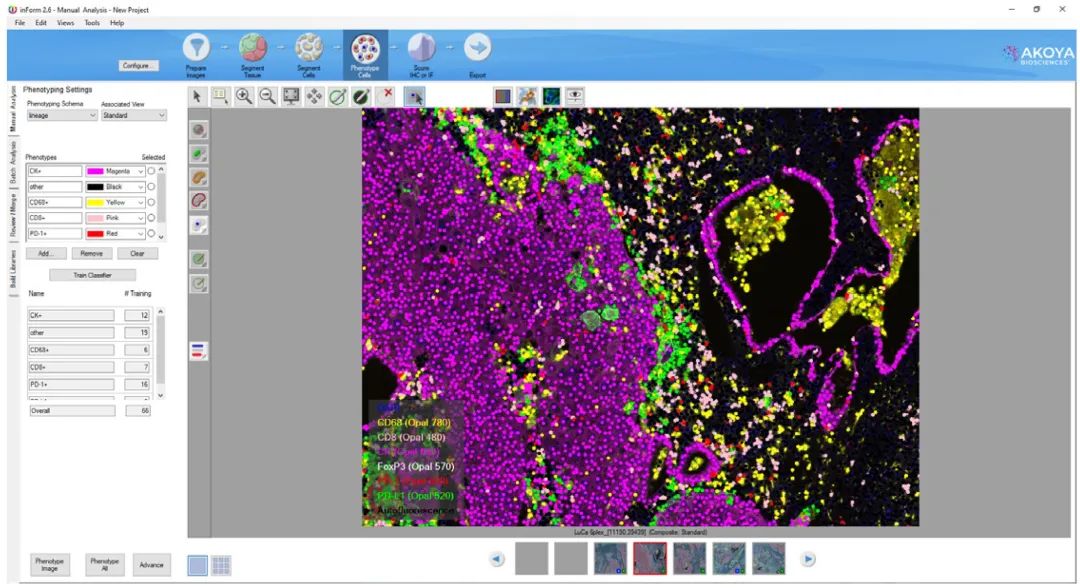
图3. Akoya Biosciences inForm软件可实现光谱拆分、分割、细胞表型分型等
首先,对多个图像测试以优化分类器,这些分类器是根据所需的分割或表型类型选择的。例如,可以使用用于识别每个细胞核的 DAPI 复染来对细胞分割进行分类。类似地,特定的标记物可用于帮助以识别不同的细胞表型。由熟悉该方法的病理学家审查数据,以确保样品的准确性,一致性和可重复性。然后,可以将细胞分割和表型数据用于更高级的分析和可视化,例如邻近分析、细胞密度和热力图。高维数据分析如 t-SNE 和 UMAP 图等也可以实现。
4. 测试验证工作流程:从染色到图像分析
在多重荧光免疫组化检测方法用于分析实验组织样本,以及最终转化为临床应用之前,端到端工作流程必须标准化和得到验证。这种验证需要检测中心内和检测中心间的比较,以证明染色强度,细胞密度和表达评估高度一致性。特别是在临床试验中,验证需要能够进行大量样品、大面积组织和可重复图像分析的多重荧光免疫组化体系[5]。
首先,选择与抗体验证相同的组织芯片和对照组织,以执行染色工作流程验证。评估在一系列切片上每种标记物染色模式的可重复性,同时考虑到表现出高特异表达的标记物可能显示出的切片之间的差异性。通常,使用第三方来评估来自不同组别产生的染色结果可有助于指导并确立可重复性[1]。
开发用于图像分析的标准化实验方法,以最大限度地减少通过人为主观分析引起的差异。为正负信号建立客观标准和强度阈值非常重要,包括假阳性和假阴性信号的示例。应记录所使用的计算图像分析算法的详细方法,并在各种测定中一致地使用。
最后,就统计方法达成共识,通过这些统计方法来比较针对不同用户、场所和实验组织类型的测试,以及组织收集和运输变量的性能分析。通过公认的标准的多重荧光免疫组化检测方法可被认为具有足够的可重复性和稳健性,可用于转化和临床研究[5]。
参考文献
1. Laberiano-Fernández C, Hernández-Ruiz S, Rojas F, Parra ER. Best Practices for Technical Reproducibility Assessment of Multiplex Immunofluorescence. Front Mol Biosci. 2021;8:660202. Published 2021 Aug 31. doi:10.3389/fmolb.2021.660202
2. Parra ER, Jiang M, Solis L, et al. Procedural Requirements and Recommendations for Multiplex Immunofluorescence Tyramide Signal Amplification Assays to Support Translational Oncology Studies. Cancers (Basel). 2020;12(2):255. Published 2020 Jan 21. doi:10.3390/cancers12020255
3. Akturk G, Parra ER, Gjini E, et al. Multiplex Tissue Imaging Harmonization: A Multicenter Experience from CIMAC-CIDC Immuno-Oncology Biomarkers Network. Clin Cancer Res. 2021;27(18):5072-5083. doi:10.1158/1078-0432.CCR-21-2051
4. Parra ER, Uraoka N, Jiang M, et al. Validation of multiplex immunofluorescence panels using multispectral microscopy for immune-profiling of formalin-fixed and paraffin-embedded human tumor tissues. Sci Rep 7, 13380 (2017). doi:10.1038/s41598-017-13942-8
5. Taube JM, Akturk G, Angelo M, et al. Society for Immunotherapy of Cancer (SITC) Pathology Task Force. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. Journal for ImmunoTherapy of Cancer 2020;8:e000155. doi:10.1136/jitc-2019-000155
6. Hanna MG, Parwani A, Sirintrapun SJ. Whole Slide Imaging: Technology and Applications. Adv Anat Pathol. 2020;27(4):251-259. doi:10.1097/ PAP.0000000000000273