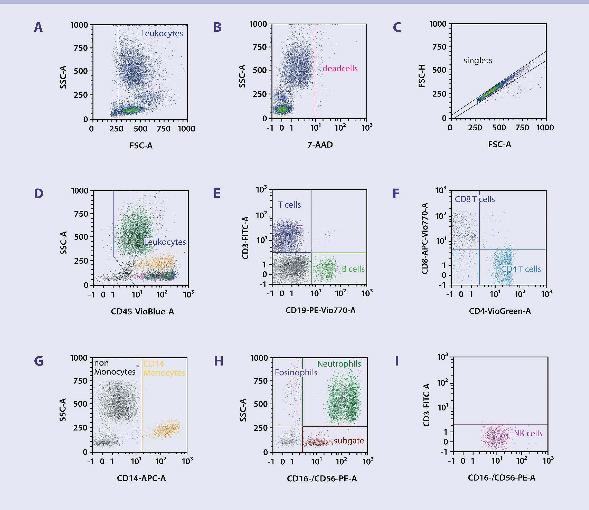
流式实验如何配色?
Elabscience
第一步、根据实验目的,选择目标 Marker。
通过阅读相关文献,了解您实验需要选择哪些 Marker,以及这些 Marker 之间的逻辑关系(圈门的父子关系,比如 T 细胞CD3 是「父」,而 CD4 或者 CD8 就是子」)。
这里列举了一些常见的细胞标志 Marker: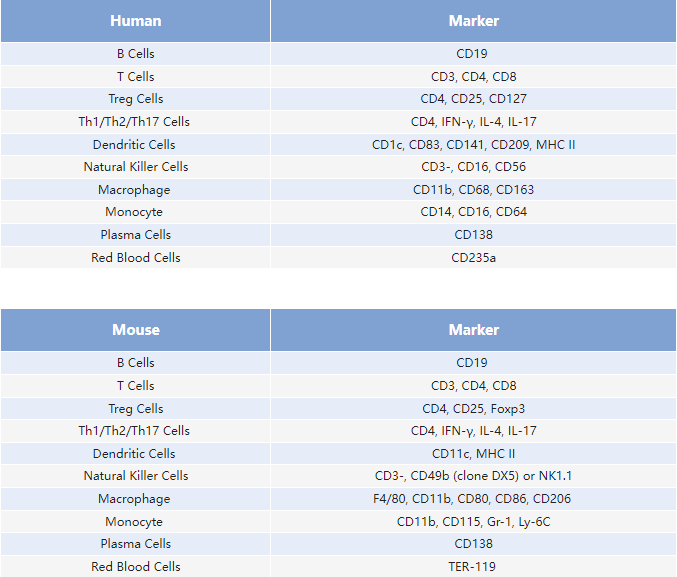
第二步、确认 Marker 的表达位置。
对于细胞质或者细胞核的 Marker,需要对细胞进行固定破膜/破核膜。在做胞质或胞核 Marker 染色实验操作时,需要先染细胞表面 Marker,再对细胞进行固定破膜,最后对胞内或核内 Marker 染色。此时细胞表面的 Marker 尽量避免使用串联染料,因为「固定」容易对串联荧光素造成影响。
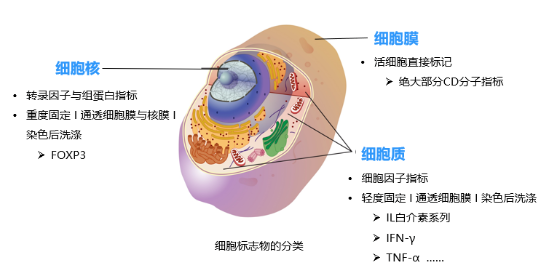
一般来说,绝大部分 CD 分子指标,都是细胞表面指标;IL 白介系列、IFN-γ、TNF-α 等,属于胞内指标;而最常见的核内染色指标是 Foxp3。
确认 Marker 表达位置的同时,我们还需要了解 Marker 的表达量。流式配色基本原则第一条是「强弱搭配」,我们需要通过表达量的强弱,来搭配荧光素的弱强。
通常,根据待测细胞类型中,相应抗原的表达量,可以粗略地将抗原分子分为三类:
1. 很容易鉴定、容易区分阴阳性细胞群、阴阳性峰明显分开的抗原。例如:CD3,CD4,CD19 等。
2. 很容易鉴定、较高水平表达、经常连续性表达。例如:CD27,CD28,CD45RA, CD45RO 等。
3. 低水平表达、激活性 Marker、未知但关键。例如:CD25,STAT5,Foxp3 等。
表达量的强弱,可以参考厂家的质检结果,但更多地需要参考文献里具体细胞群体的表达。
第三步、了解实验所用流式细胞仪的配置信息,包括:流式细胞仪的激光器、检测通道和滤光片等。
上期提到:流式细胞仪是同时检测多种荧光的,这些荧光之间可能存在干扰。我们需要根据流式细胞仪的通道,来确认有哪些荧光素可以选择,这样可以在后期搭配的时候,尽量避免干扰。如果没有仪器的通道信息,是无法去确定哪些荧光素可供选择的。可以说,如果没有仪器通道信息,配色就是「无源之水,无本之木」。
通过仪器通道信息,确认可以选择哪些荧光素后,我们还需要了解荧光素的信息,确认这些荧光素的激发波长和发射波长、接收该荧光的滤光片等信息,是否和流式细胞仪的通道一致。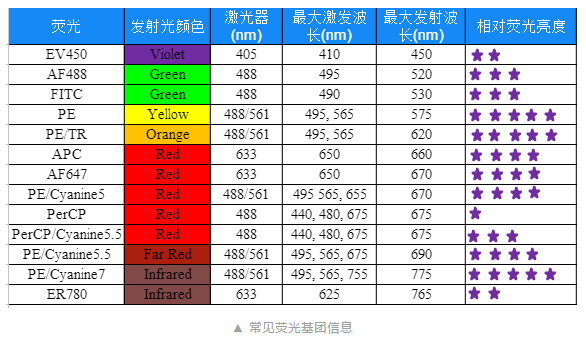
第四步、了解荧光素的强度。
下表列出了常见荧光素的强度:
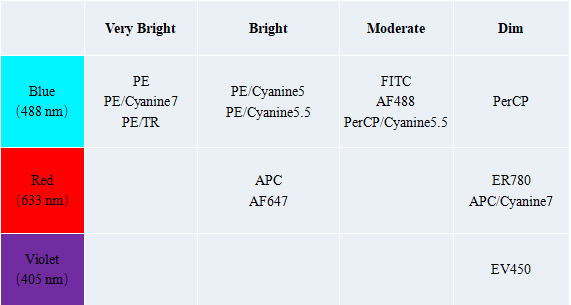
在已确定 Marker 的强弱,和流式细胞仪可检测的荧光素的强弱后,我们要遵循「强弱搭配原则」,进行配色。
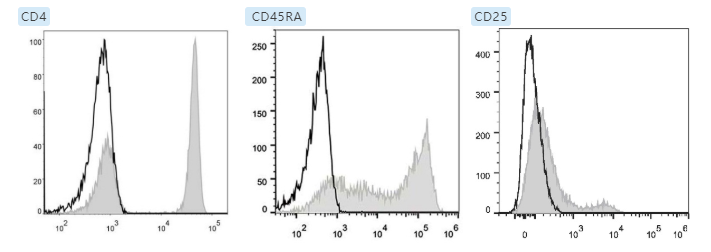
强表达抗原,可以选择弱荧光素,也可以选择强荧光素。
如下图所示,强表达抗原 CD3,选择弱荧光素 FITC 或强荧光素 APC,对实验结果影响不大。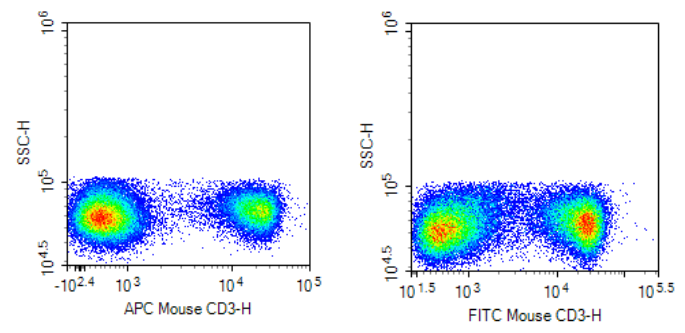
弱表达抗原,一定要选择强荧光素。
如下图所示,弱表达的抗原 CD25,选择弱荧光素 PerCP,会导致阴阳性细胞群分不开。如果选择强荧光素 PE,可以看到明显的阳性细胞群。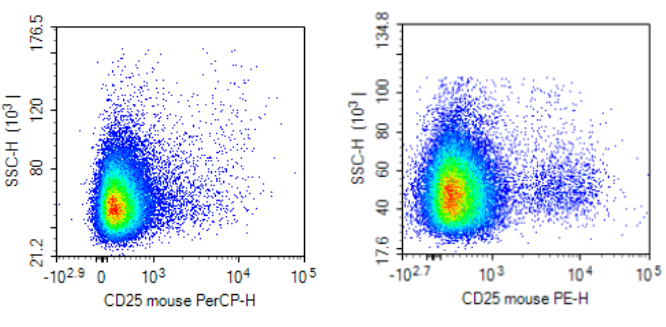 当然,有些老师在配色时,也会遇到一些其他的问题,如:细胞样本有自发荧光、细胞处理容易出现死细胞(需要额外增加死活细胞染料)等。因此,我们需要特别注意,将对应通道的荧光检测信息,预留给自发荧光,或者死活染料检测。相信在了解了流式配色的基本原则及操作步骤后,大家的实验也能更加顺利地开展啦~
当然,有些老师在配色时,也会遇到一些其他的问题,如:细胞样本有自发荧光、细胞处理容易出现死细胞(需要额外增加死活细胞染料)等。因此,我们需要特别注意,将对应通道的荧光检测信息,预留给自发荧光,或者死活染料检测。相信在了解了流式配色的基本原则及操作步骤后,大家的实验也能更加顺利地开展啦~