免疫荧光有结果 WB 却没条带?问题可能出在这一步…
英文特
实验室中时常听到这样的困惑,「明明通过免疫荧光(IF)能看到目的蛋白表达在细胞核膜上的表达,但为什么不论用总蛋白还是核蛋白进行 WB 检测,都无法检测到目的蛋白?」 类似这样的问题,你是否也深有感触?
实际操作过程中,是否遇到过免疫荧光有结果而蛋白印迹却没条带的情况?什么原因导致了这种情况?又该如何处理?
一、IF & WB
免疫荧光(IF)和免疫印迹(WB)都是利用抗原和抗体的特异性结合对目的蛋白质进行检测。IF 采用抗体和荧光检测固定细胞或组织中目的蛋白的定位、相对表达和激活状态;而 WB 则通过分析条带位置和着色条带深度来获取目的蛋白质在细胞或组织中表达情况的信息。
IF 的数据评估依赖于视觉判断,其结果的解释具有主观性[1]。因此,通常情况下,IF 实验更适合对目的蛋白分布范围、空间相互关系进行评价;而 WB 实验常用于对目的蛋白进行定性和半定量分析[2]。
二、可能的原因
IF 实验是原位检测技术,而 WB 实验则需要先将靶蛋白提取出来再进行检测。IF 实验能检测到目的蛋白,而在 WB 中却没有出现目的条带,其常见的原因有两个:一是目的蛋白表达量过低,无法达到 WB 检测下限;二是在样品制备过程中,目的蛋白发生了丢失。
总的来说,就是蛋白样品出了问题!
三、如何解决
首先,我们需要了解目的蛋白的情况。通常我们可以借助 UniProt、BIOGPS、GEPIA、The Human Protein Atlas 等工具查询目的蛋白相关信息,明确目的蛋白的表达量、定位信息等基本情况之后,做出初步原因判断,再选择相应的解决方案。
(1)增溶目的蛋白
蛋白提取的过程实际可以看作是样品中蛋白溶出到裂解液中的过程。而在溶出过程中,不同的裂解液配方溶解效率不同,通常使用的 NP-40、RIPA 等裂解液无法将所有蛋白全部溶出(如图 2),已经有研究发现细胞骨架、细胞外基质蛋白及部分膜蛋白、核蛋白等属于难溶蛋白,在提取过程中会形成不可溶沉淀[3]。如果目的蛋白属于这类难溶蛋白,仅使用可溶性组分(上清)用于 WB 实验时,目的蛋白将无法被检测到。针对这种情况,我们可以选择更加有效的裂解液配方,或者使用柱式蛋白提取法来增溶目的蛋白。例如,使用柱式法总蛋白提取法,可有效溶解难溶蛋白,避免不可溶组分的产生,有效解决蛋白丢失问题,从而提高目的蛋白检出率[4]。
(2)分离亚细胞结构富集目的蛋白
如果目的蛋白表达量较低或增溶后仍未检出条带,可根据目的蛋白定位进行亚细胞结构分离以富集目的蛋白,降低检测难度[5]。例如:当目标蛋白为跨膜蛋白时,其表达量低且难以提取,这种情况下可以先富集膜蛋白后再进行 WB 检测,有效降低检测难度且检测结果更清晰(如图 3)。使用柱式法亚细胞结构分离系列工具,无需超高速离心,无需自配溶液,无需研磨仪即可分离细胞膜、细胞核、内质网、高尔基体、溶酶体等亚细胞结构,大大降低了 WB 检测难度。
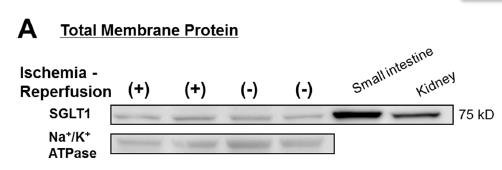
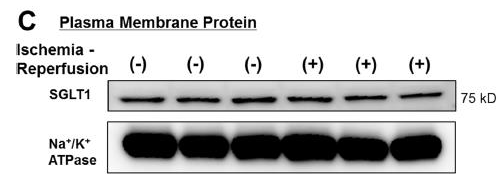
图 1. 富集质膜组分后检测跨膜蛋白更易检出:目的蛋白 SGL1 是跨膜蛋白,使用总膜蛋白检测困难,使用柱式法质膜及细胞组分分离试剂盒富集质膜后再检测质膜组分,可以显著提高 SGL1 的检出效率。
(图片来源:Kashiwagi Y,2015,PLoS ONE 10(6):e0130605. doi:10.1371/journal.pone.0130605.)
(3)有条件诱导目的蛋白表达
如果通过增溶目的蛋白或分离亚细胞结构富集目的蛋白,仍无法得到 WB 条带,可通过查阅相关文献了解是否可以有条件的诱导目的蛋白的表达,以助于 WB 实验的检测。例如,XPC 蛋白主要表达于细胞核上,在 U87 细胞中表达量远低于 Hela 细胞(抗体说明中的阳性对照),查阅文献后得知 TMZ 诱导可以显著促进 XPC 入核[6]。因此,可以使用 TMZ 诱导 2 周后再开展后续实验。
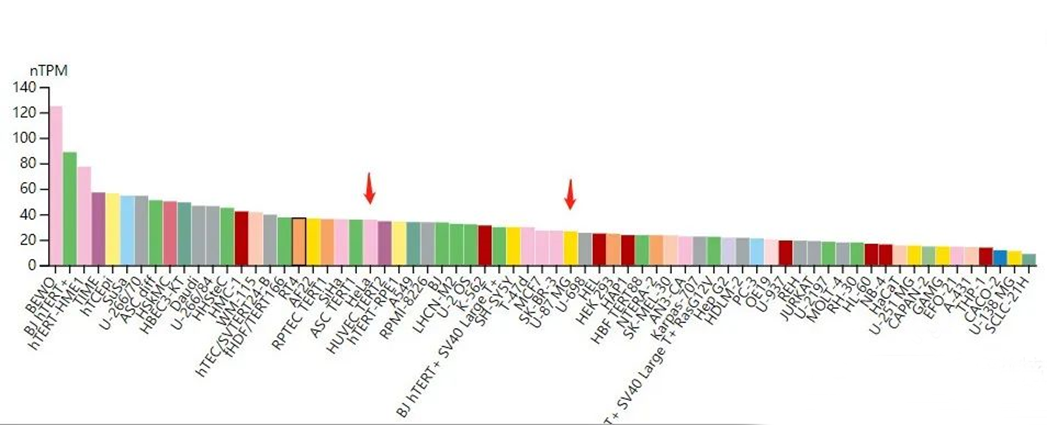
图 2. XPC 在不同细胞中表达情况
(图片来源:The human protein atlas)
四、小结
除去抗体及操作失误等因素,当出现 IF 有结果而 WB 无条带的情况时,我们首要考虑蛋白样品的制备问题,可通过增溶目的蛋白、分离亚细胞结构富集目的蛋白或诱导目的蛋白表达等方法提高蛋白检出率。蛋白样品制备作为 WB 的起始步骤,是尤为关键的一步,实际操作中的每一个细节都不容忽视。尽可能提高蛋白样品的质量,有助于更好更快的达到我们预期的实验结果。









