外泌体载药研发新突破:小 RNA 的新武器
和元生物
外泌体(Exosomes)是细胞分泌到胞外的一种囊泡,大小为 30-150 nm,携带了各种核酸、蛋白质和脂类等物质,可以在不同细胞间进行传递和交流,从而影响受体细胞的生物学功能。
外泌体在大小和功能上与合成的纳米颗粒类似,但作为天然内源性载体,具有免疫原性低、毒性低、稳定性高、渗透性好等优势,故可能成为更有应用前景的药物递送载体。目前,外泌体已经成功运载基因类药物、抗癌药物和抗炎症药物等其他类型药物。
1.安全:从患者体内获取的外泌体,经载入基因后,再注入患者体内几乎不会引起免疫反应,更加安全;
2.保护性强:外泌体粒径较小,可以逃过网状内皮系统的捕捉,有效保护承载的基因;
3.运载效率高:外泌体可以通过与受体细胞膜融合的方式,将基因类药物释放到细胞质中。
近期,和元生物研发团队展示了他们在外泌体载药上的研发进展,分别用电转法和共孵育法做了 miRNA 和 siRNA 两部分装载的探索。根据数据结果显示,相比共孵育法,电转法能更有效地将 miRNA 和 siRNA 这些小 RNA 载入到外泌体中,这为后续验证 miRNA 和 siRNA 对体内外功能的影响奠定了基础。下面具体介绍实验过程和结果。
一、外泌体载药之 miRNA 装载篇
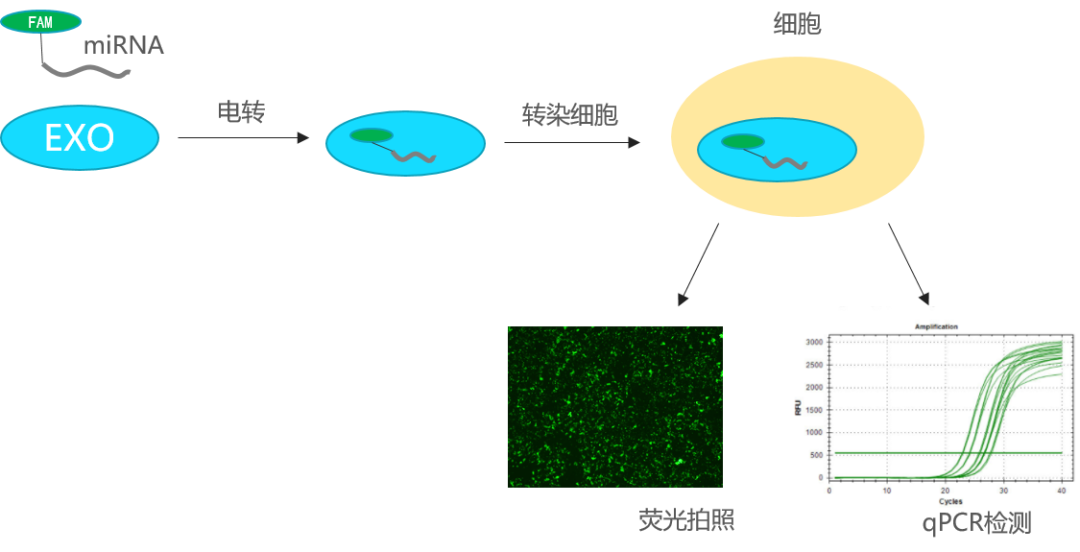
图一 外泌体 miRNA 装载及检测示意图
1.实验结果:
1)外泌体超离后,根据透射电镜(TEM)、NTA 和 WB 的鉴定结果,我们获得了高质量的外泌体,用于后续电转和共孵育实验。
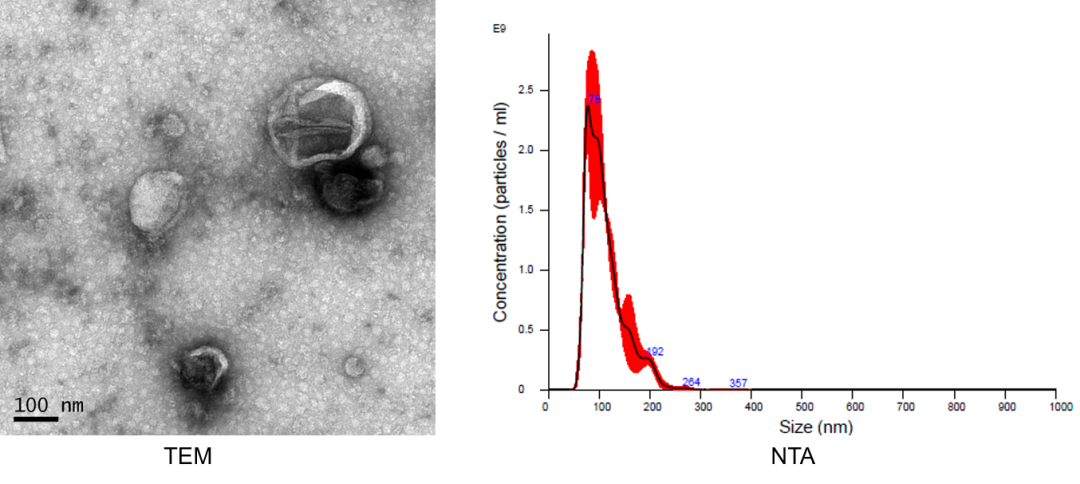
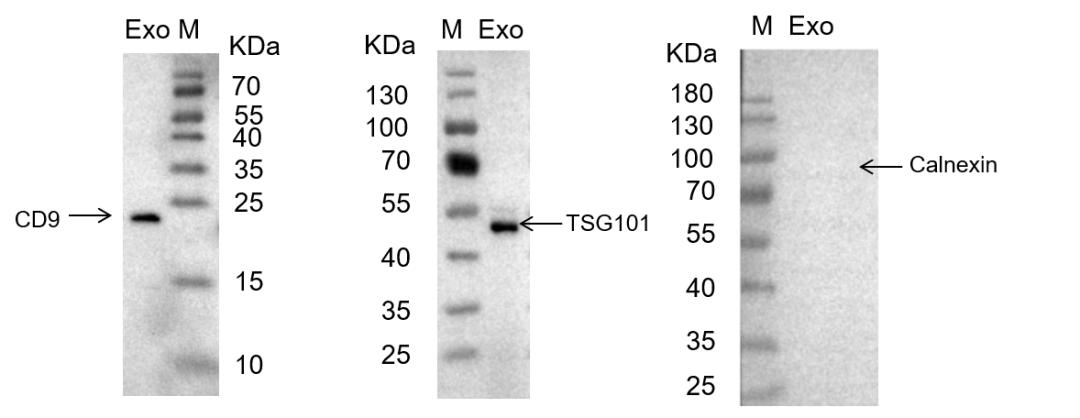
图二 外泌体鉴定(TEM、NTA、WB)
2)外泌体经电转和共孵育后,通过 qPCR 方法检测外泌体中 miR-21-5p 的水平,数据显示,电转后外泌体中 miR-21-5p 的水平显著高于共孵育后 miR-21-5p 的水平。
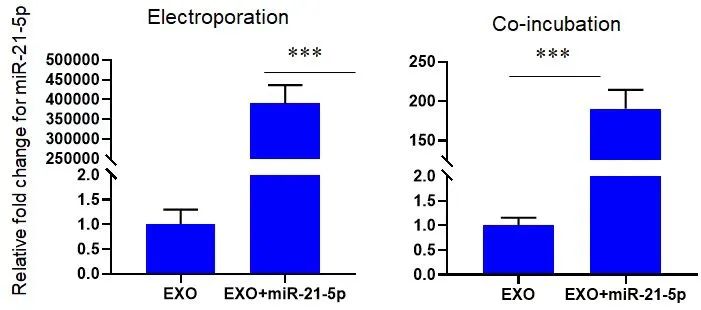
图三 qPCR检测外泌体中 miR-21-5p 含量
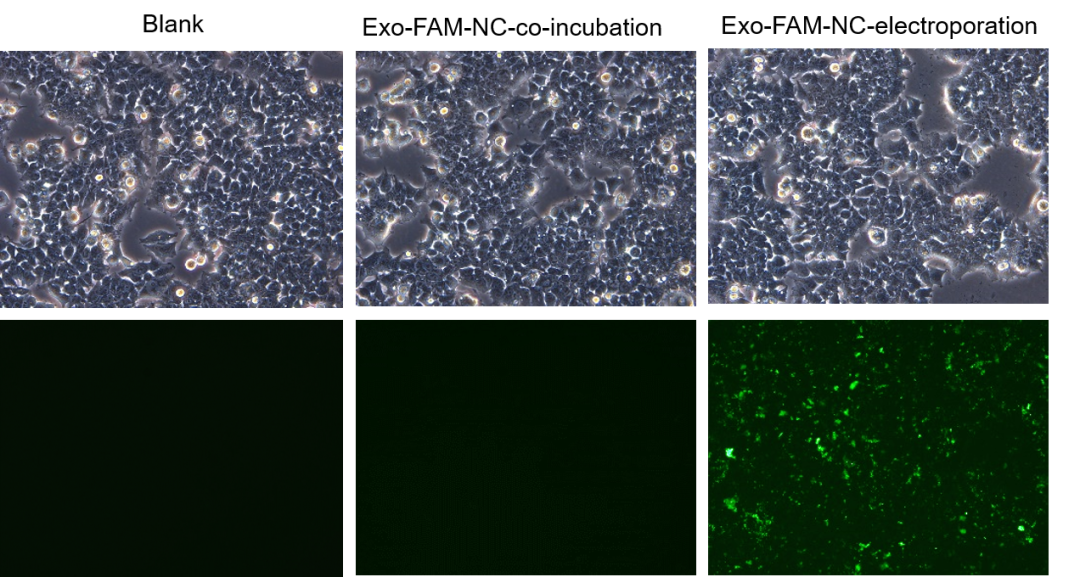
图四 外泌体电转和共孵育转染荧光对比
4)从检测目的细胞中 miR-21-5p 的 RNA 水平可以看出,与上述转染结果一致,通过电转法将 miR-21-5p 转载入外泌体中,再用此外泌体转染目的细胞,发现目的细胞中 miR-21-5p RNA 水平显著高于用共孵育法带来的 RNA 水平变化。
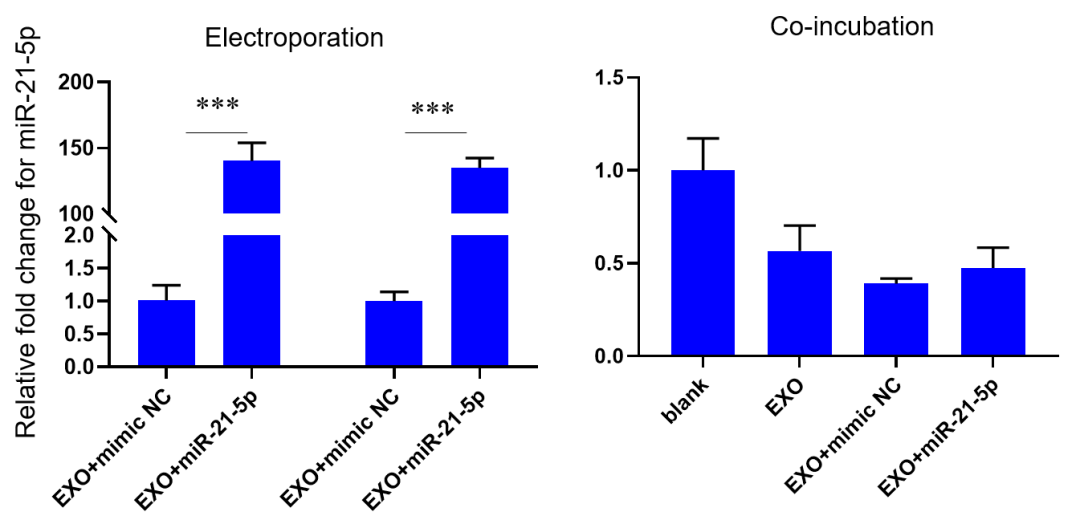
图五 qPCR 检测外泌体电转和共孵育对目的细胞中 miR-21-5p RNA 水平的影响
2.实验讨论:
基于本次的实验数据,我们可以看出,用电转法将 miRNA 转载入外泌体中是切实可行的,且效率要远高于用共孵育法。但是需要注意的是,不同批次不同来源的外泌体,其电转效率有差异,同时不同细胞摄取外泌体的能力不同,因此使用不同批次不同来源的外泌体电转时,需要做外泌体和 miRNA 梯度预实验确定以外泌体和 miRNA 的最佳使用量。
二、外泌体载药之 siRNA 装载篇
1.实验结果:
1) 通过 qPCR 法检测电转组和共孵育组外泌体中 siRNA 水平,数据结果显示,电转组的 RNA水平显著高于共孵育组,表明 siRNA 通过电转进入外泌体的效率较高。
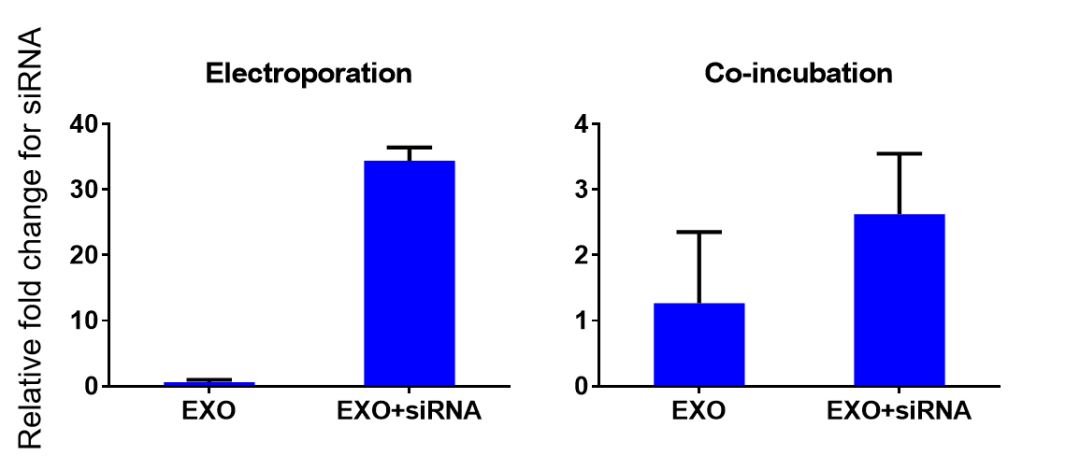
图六 qPCR 检测电转组和共孵育组外泌体中 siRNA 水平
2) 从细胞中外泌体的荧光情况看,电转组里除了外泌体本身的绿色,还有 Bcl-2 siRNA 的红色标记,说明 Bcl-2 siRNA 通过电转被装载入外泌体中;而共孵育组中基本没有摄入 Bcl-2 siRNA,故通过电转法能将 siRNA 有效地装进外泌体中。
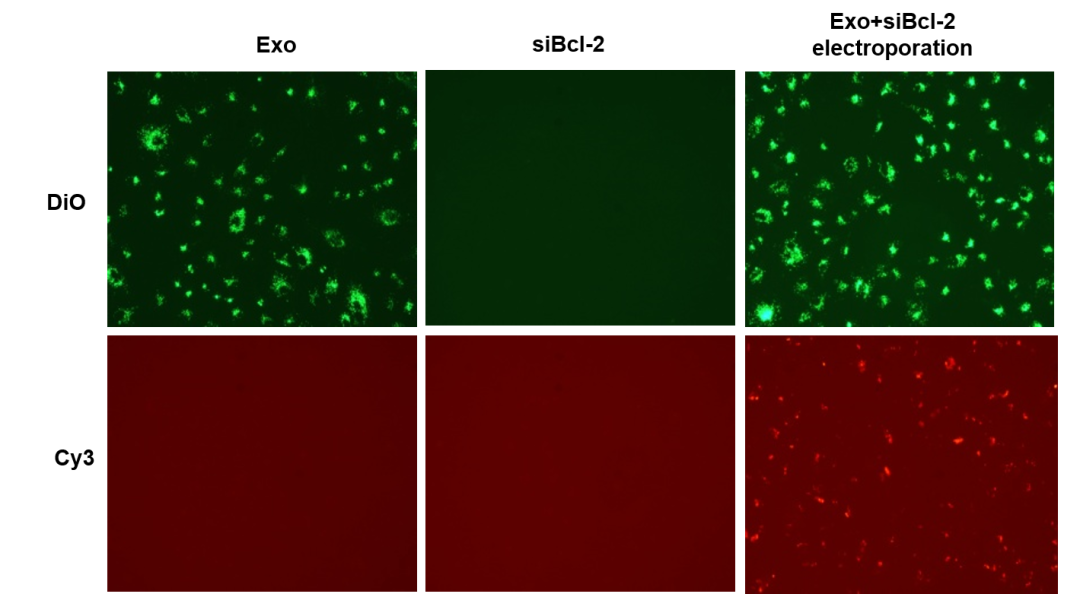
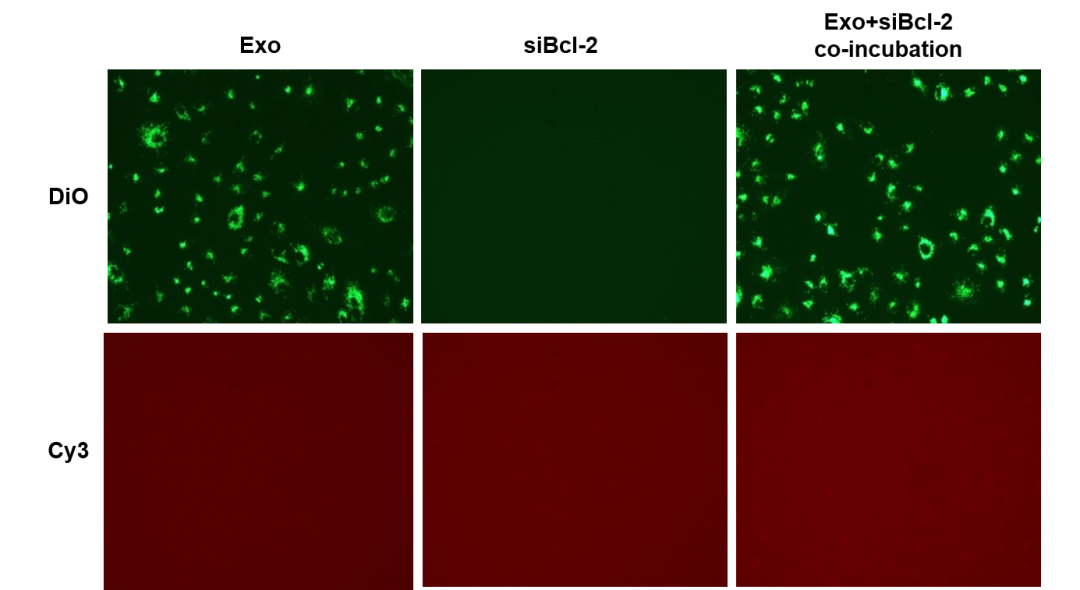
图七 电转组和共孵育组与细胞共培养24h后观察外泌体荧光情况
3)通过共聚焦显微镜观察电转组外泌体中 siRNA 的载入情况,从共聚焦显微镜拍摄的结果看,电转组外泌体中有进入了大量的 Bcl-2 siRNA。
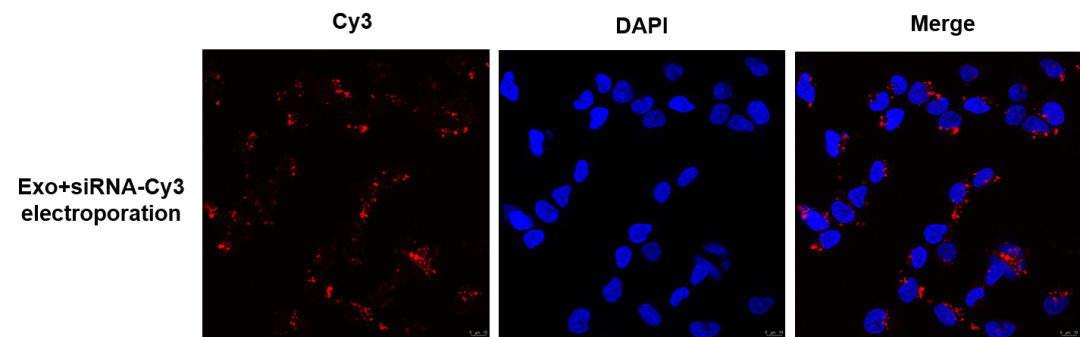
图八 共聚焦显微镜检测外泌体中 siRNA 装载情况
通过本次实验数据可以看出,对于 siRNA 的外泌体装载,电转法装载的效率较高。后续实验可以进一步检测细胞中 siRNA 引起的基因水平变化,以及对应的细胞功能学的变化。未来的实验结果,我们拭目以待!
