CELL | 线粒体 DNA 编辑技术最新进展
丁香实验
1953 年,沃森(James Dewey Watson)和克里克(Francis Harry Compton Crick)揭示了 DNA 双螺旋结构,自此开启现代分子生物学波澜壮阔的历史。1968 年,阿尔伯(Werner Arber)、内森斯(Daniel Nathans)和史密斯(Hamilton Othanel Smith)发现了如同精准的手术刀、切割特定 DNA 片段的限制性核酸内切酶,从此拉开了 DNA 编辑技术的序幕。1985 年,穆斯利(Kary Mullis)发明聚合酶链式反应,即体外特异性地大量扩增核酸序列的 PCR 技术。
上述三大了不起的发现均荣膺诺贝奖,随着科学技术车轮缓缓向前,基因编辑技术在此基础上应运而生!
自 20 世纪 90 年代以来,一系列基因编辑工具,如锌指核酸酶(ZFN)、转录激活因子样效应蛋白核酸酶(TALEN)、CRISPR 系统及单碱基编辑技术等基因编辑技术,被用以对基因组进行定点修饰。其中 CRISPR 系统及单碱基编辑技术更是在基因组编辑领域掀起了一场真正的革命!
然而,这些基因编辑工具在面对线粒体 DNA 的编辑时,却显得有心无力。2020 年,Broad 研究所的刘如谦(David Liu)团队开发了一款能够直接修改双链 DNA 上的碱基,实现从 C 碱基到 T 碱基的转换、被命名为DdCBE 的工具,首次掀开了线粒体 DNA 编辑的冰山一角,让人们看到治疗线粒体疾病的曙光 [1]。
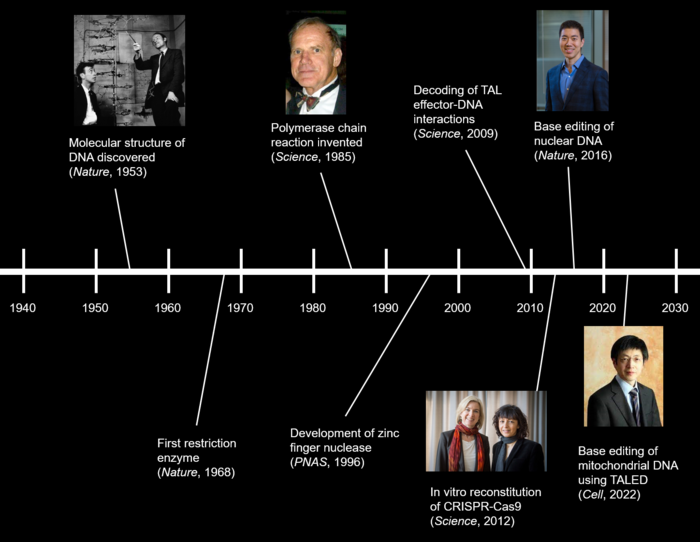
图 1 来源:William I. Suh, Institute for Basic Science
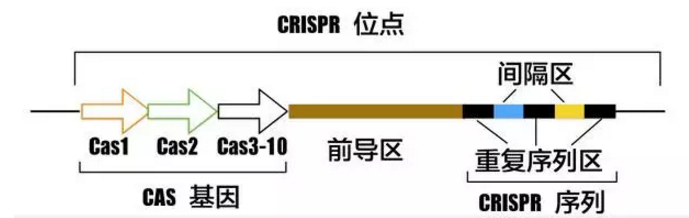
一、线粒体 DNA 编辑领域的新革命
2022 年 4 月 25 日,韩国基础科学研究所(IBS)的 Jin-Soo Kim 实验室在 Cell 杂志发表研究论文 Targeted A-to-G base editing in human mitochondrial DNA with programmable deaminases [2]。该论文以刘如谦团队开发的线粒体基因组精准编辑工具 DdCBE 为基础,进一步结合腺嘌呤脱氨酶 TadA 的研究成果,开发出了可对线粒体基因组进行 A-G 精准编辑的新工具 TALEDs(transcription activator-like effector-linked deaminases),为基因编辑技术领域填补了一项重要的空白,将长达数十年的治愈人类遗传疾病之旅推向了高潮!

图 2:来源 Cell
研究人员通过融合三种不同的成分创造了 TALED。第一部分是转录激活因子样效应物(TALE),它能够靶向特定的 DNA 序列;第二部分是 TadA8e,一种腺嘌呤脱氨酶,用于实现 A 到 G 碱基的转换;第三个主要部分是一种胞嘧啶脱氨酶 DddAtox,使 DNA 更容易被 TadA8e 捕获并编辑。研究人员推测,DddAtox 可以使得双链 DNA 短暂地解开双链,TadA8e 正是通过这个短暂的时间窗口,对 dsDNA 进行快速的编辑。
有趣的是,TadA8e 一直被认为是一种仅对单链 DNA 具有特异性的蛋白质,但在这里被用于在线粒体的双链 DNA 中进行碱基编辑。这篇论文的通讯作者 Kim 教授表示:「以前没有人想过用 TadA8e 在线粒体中进行碱基编辑,因为它被认为只对单链 DNA 具有特异性作用。正是这个跳出传统框架的思维方法,帮助我们发明了 TALED。」
该研究首先将 DdCBE 中的部分 UGI 替换为 TadA8e 并研究其碱基编辑活性,发现改造后的 sTALED-UGI 具有明显的 A-G 编辑活性(19%),并保留着 C-T 编辑活性。进一步删除其余 UGI 功能域,最终得到的 sTALED 工具只保留有 A-G 编辑活性,且对线粒体基因组的编辑效率最高可达 49%。
在此基础上,研究者们设计出两种新工具——单体 TALEDs(mTALEDs)和二聚体 TALEDs(dTALEDs)。根据不同的 A-G 编辑需求,通过筛选优化 TALE 结合位点,改变三种 TALEDs 的活性窗口,即可精准地实现线粒体基因组编辑!
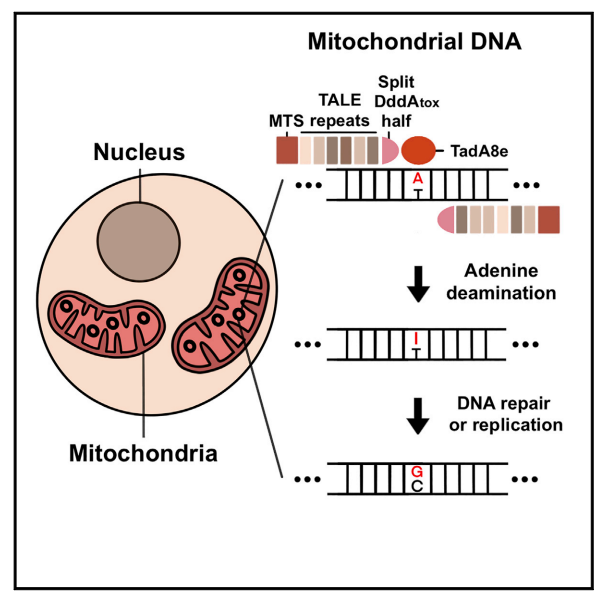
图 3:来源 Cell
令人振奋的是,TALEDs 对线粒体基因组的 A-G 单碱基编辑能稳定遗传,在线粒体 DNA 和细胞核 DNA 水平的脱靶风险很低。该项新发现攻克了 CRISPR-Cas 系统因为向导 RNA 不能穿越线粒体膜的难题,为线粒体基因组编辑开创了新的广阔前景。
研究人员表示,未来的目标是通过提高编辑效率和特异性来进一步改善 TALEDs,最终为纠正胚胎、新生儿或成年患者中致病的 mtDNA 突变铺平道路。
二、线粒体基因组编辑
在哺乳动物中,细胞核和线粒体可以储存遗传信息。此外,线粒体作为细胞中的微小细胞器,小小的身体却有着大大的能量,可谓是「细胞的发电站」,是能量产生的工厂。
人类线粒体基因组 16,569bp,从母系遗传而来,其中 95% 的序列编码 13 种蛋白质、22 种 tRNA 以及 2 种核糖体 RNA,这些 RNA 对于氧化磷酸化过程以及 ATP 形式的细胞能量的产生至关重要。目前已知线粒体 DNA 中有 90 种致病点突变,每 5000 人中至少有 1 人会发生这种突变,当发生基因突变,就会引起与能量代谢相关的严重遗传疾病,如二型糖尿病、心肌病以及神经退行性疾病。
令人遗憾的是,限于技术和动物模型构建的障碍,尽管基因编辑在细胞的核基因组方面取得了很大的成功,但在编辑线粒体方面并不顺利。
2020 年,刘如谦教授团队开发的名为 DdCBEs 的基因编辑工具,可以实现线粒体 DNA 从 C 碱基到 T 碱基的转换,这也是科学家首次在人体细胞中进行线粒体 DNA 的编辑。但是,该技术存在一定的局限性,它不只是仅限于 C 到 T 碱基的转换,而是只能进行 TC-TT 序列的转换。这意味着它只能纠正 90 个已确认的致病性线粒体点突变中的 9 个(= 10%)。
值得注意的是,在人类线粒体 DNA 中,若能进行 A 到 G 碱基的转换,可以纠正 90 种已知致病性突变中的 39 种(= 43%)。但在很长一段时间内, 线粒体 DNA 的 A 到 G 碱基的转换被认为是不可能的。而如今 TALEDs 平台的建立,无疑是治疗人类遗传疾病的一剂强心剂,为掌握线粒体背后的生命密码、实现基因组信息精准编辑提供了利器!
三、基因编辑技术的临床应用
基因编辑技术为攻克人类疑难杂症而生,用来失活或者修正病人体内的致病基因,为患有遗传疾病的人们提供第二次生命,其中囊泡性纤维症、亨廷顿舞蹈症、杜氏肌营养不良以及镰刀型贫血症均是因单个基因突变引起的疾病,令无数人深陷疾病阴影,带来巨大的生理和心理负担。基因编辑的临床潜在应用为治疗上述疾病带来了新的希望。
基因编辑技术的临床应用具有广阔的前景,技术日新月异的发展更是令人振奋不已,然而其应用必须受到科学家、医生、生物伦理学家以及监管机构的通力合作,绝不可肆意而为,方才能合理有效地应用这把双刃剑,保证其有效性和安全性。
如今,线粒体基因组编辑技术障碍被攻克,为基因编辑技术的临床应用增砖添瓦,为线粒体功能和基因治疗研究提供了新希望。如何把握科学技术与伦理道德间的界限与平衡,亦需要得到科学家们的重视,其后续发展让我们拭目以待!
参考文献:
1. Mok, B.Y., de Moraes, M.H., Zeng, J. et al. A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. Nature 583, 631–637 (2020).
2. Sung-Ik Cho, Seonghyun Lee, Young Geun Mok, Kayeong Lim, Jaesuk Lee, Ji Min Lee, Eugene Chung, Jin-Soo Kim. (2022). Targeted A-to-G base editing in human mitochondrial DNA with programmable deaminases. Cell. https://doi.org/10.1016/j.cell.2022.03.039