DNA甲基化研究方法的回顾与评价(下)
互联网
2.2.10 DNA微阵列法
Yan等2001年[40]将以分子杂交为基础的微阵列技术应用于DNA甲基化检测中,这种方法是基于杂交的寡核苷酸微阵列,是一种在基因组中寻找新位点的方法。包括用于整个基因组范围内扫描的差异甲基化(DMH)杂交(Huang等1999年[41])和用于检测某个位点的甲基化特异性微阵列MSO(Gitan等2002年[42])。前者类似于mRNA表达谱或cDNA微阵列,是CpG岛微阵列,后者类似于寡核苷酸微阵列,是针对CpG二核苷酸位点的甲基化特异性寡核苷酸微阵列[26]。
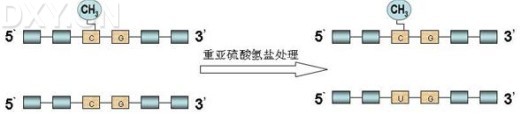
MSO要求预先设计一对含有2个不相邻的GC(或AC)的探针,用于识别甲基化和非甲基化的序列,其中含GC的探针(5[42]'---GC---GC---3')识别甲基化序列,含AC的探针(5'---AC---AC---3')识别非甲基化序列,探针的5'端通过Linker固定于玻璃板上。首先对待研究片段用重亚硫酸盐处理,将非甲基化的胞嘧啶变为尿嘧啶,甲基化的不变,再行PCR扩增,产物的3'端用荧光素标记,移至连有探针的玻璃板上进行杂交,通过检测杂交后产生的荧光强度判断待测序列中甲基化的水平。此方法一定要设立对照。该法可用于多样本、多位点甲基化的检测,样本需要量少,适于临床样本,但存在假阳性问题。
2.2.11 甲基化敏感性斑点分析(methylation sensitive dot blotassay,MS-DBA)
G Clément等2005年[43]报道了一种新的方法,能够定量或半定量分析样本中的甲基化水平。这个方法的过程是:先用重亚硫酸盐处理待测DNA片段,随后以非CG区的引物行PCR扩增,将扩增产物变性后转移到尼龙膜上,用3'端DIG标记的含有2个CG(或TG)的双核苷酸探针与DNA杂交,随后用带有荧光标记的抗DIG抗体与之反应。与双CG的探针获得杂交的标本含有甲基化,而与TG探针杂交的标本未被甲基化。通过比较斑点上荧光的强度测定甲基化水平。
这种方法的优点是快速、简便、易于掌握,可一次检测多种样本,包括石蜡包埋样本。缺点是:1. 检测序列不能过长;2. 若探针错误杂交或重亚硫酸盐处理不完全,则可能出现假阳性或假阴性结果。
2.2.12 甲基化特异性多连接依赖性探针扩(Methylation-Specific multiplex ligation-dependent probe amplification,MS-MLPA)
Anders O.H.等2005年改进MLPA[44]为MS-MLPA[45]用于检测特异位点的甲基化。MS-MLPA中,针对甲基化的和非甲基化的位点分别设计两个探针,每个探针都包括两个寡核苷酸部分,其中短的部分由合成产生,长的部分来源于phageM13的衍生物,后者有一个非杂交填充片段,不同探针其长度不同。探针的两个寡核苷酸杂交序列均与目标序列互补,其末端都连有相同的PCR引物。且要求[45]设计的MS-MLPA的探针要有甲基化敏感的限制性内切酶HhaⅠ(GCGC)或HpaⅡ(CCGG)的识别位点,这样,经探针和目标序列杂交后,降低反应体系温度,并向其中加入连接酶HhaⅠ,若原样本DNA中含有HhaⅠ识别的非甲基化的位点,则非甲基化探针的两个寡核苷酸部分不能连接,而甲基化的探针顺利连接不被切割,在随后的PCR反应中只有两个寡核苷酸部分连接后的探针才能被扩增。最后分析扩增片段,确定待研究位点的甲基化情况(具体过程见图8)。
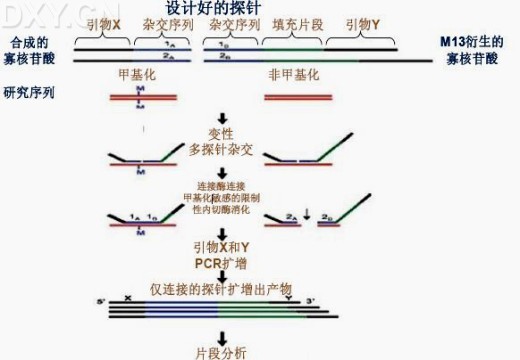
图8:甲基化特异性多连接依赖性探针扩增(MS-MLPA)示意图。用设计好的甲基化与非甲基化的探针(探针各寡核苷酸部分含有杂交序列,不同探针其填充片段的长短不同)分别与待测DNA杂交,结合上的寡核苷酸探针经连接酶连接,若DNA片段中存在甲基化位点,则带有(HhaⅠ)识别位点的探针不能被切割,同理,若为非甲基化,则DNA片段被HhaⅠ切开,且探针不能被连接,这样,在随后的PCR扩增过程中,只有连接的探针能被扩增,最后对扩增的片段进行分析,得出原DNA中特异位点甲基化的情况(图8参考引文[45])。
这种方法的优点是:1.需要样本的数量少,由于探针具有非常短的识别序列,因此MPLA可以用于局部降解的DNA,如从石蜡包埋的DNA样本;2.可用于分析大量混合样本。缺点是探针连接位点受限制性内切酶位点识别的限制,且要考虑到所用酶的反应适宜温度。
2.3甲基化新位点的寻找
随着甲基化研究水平的提高,近年来,提出了以限制性标记基因组扫描(RLGS)为代表的一系列新兴的全基因组甲基化扫描分析的新技术,另如:甲基化敏感的限制性指纹谱技术(methylation-sensitive restriction fingerprinting technique, MSRF)、甲基化间区位点扩增(amplification of inter-methylated sites, AIMS)等,这些新技术的出现为甲基化胚胎发育、肿瘤细胞异常基因印记向更深层次的发展提供了有效方法学工具。简单说来,[46][47][48] 1.RLGS是将稀有切点限制酶(NotⅠ)和二维凝胶电泳相结合,与NotⅠ-Eco RV文库进行对比分析,检测、扫描全基因组甲基化的情况。它的缺点是只能分析基因组中50%左右的CpG岛;2.MSRF用到限制性内切酶,如:MseⅠ、BstUⅠ,并采用10碱基随机引物扩增差异甲基化片段,几乎可以检测全基因组所有CpG岛,但此方法复杂、需要后续鉴定、技术难度高;3.AIMS技术采用甲基化敏感和甲基化不敏感同裂酶(isoschizomer)裂解以及接头(adaptor)引物扩增甲基化间区序列,此方法可通过接头引物控制扩增带的复杂程度,且所得片段在200-2000bp之间,可以直接克隆到载体并测序。优点是简单方便,可以作为全基因组差异印记基因筛选的有效工具。
2.3.1 限制性标记基因组扫描(restriction landmark genomic scanning,RLGS)
Costello等2000年报道的RLGS[46,49]能对整个基因组的甲基化状态进行分析,发现新甲基化基因的方法。这种方法联合使用了限制性内切酶及二维电泳。其过程是:先用甲基化敏感的稀频限制性内切酶NotⅠ消化基因组DNA,甲基化位点保留,标记末端、切割、行一维电泳,随后再用更高频的甲基化不敏感的内切酶切割,行二维电泳,这样甲基化的部分被切割开并在电泳时显带,得到RLGS图谱与正常对照得出缺失条带即为甲基化的可能部位[5]。
这种方法可同时分析不同肿瘤中甲基化模式的异同和寻找肿瘤内DNA甲基化的新靶点,由于新发现的甲基化新靶点的作用尚不清楚,因此其需要后续进一步分析确定,此外,RLGS图谱不能完全确认所缺失的片段是由于甲基化所致还是由于DNA本身缺失所致[5]且结果分析复杂,不易解释。
2.3.2 MBD(Methyl-CpG binding domain column chromatography,甲基化结合区)柱层析法
根据MBD蛋白家族和MeCP2的特性,Masahiko Shiraishi等2004年[50]提出了一种新的方法MBD柱层析法,用于筛选和发现基因组中甲基化的情况。并且比较了MBD和重亚硫酸盐基因组测序法,得出:用MBD柱层析法分析得出的甲基化片段均能用重亚硫酸盐测序法证实[50]。
现已较清楚CpG岛的甲基化在基因沉默中起着重要作用,但其过程中的很多具体环节及机制尚不清楚[51]。如:基因沉默是由启动子区个别位点CpG发生甲基化引起的,还是由全部的CpG发生甲基化而引起的。但研究认为启动子区胞嘧啶甲基化导致基因表达沉默并非是由于甲基基团阻碍了转录因子的结合,而是由于那些能与甲基化区特异性结合的蛋白发挥作用[52,53]而引起的。
已发现一些能与CpG甲基化位点特异性结合的蛋白,一种是MeCP1,它能够与对称性多位点甲基化CpG位点相结合,另一种是MeCP2,不同于MeCP1的是它能够与单甲基化CpG位点特异结合,且不与半甲基化位点结合。而且报道的MBD1、MBD2、MBD3、MBD4蛋白都与MeCP2有着相同的特性[54,55]。
这种方法是:MBD柱中含有甲基化位点特异性结合蛋白的功能区(Methylation Binding Domain, MBD),能够与甲基化位点特异性结合。该蛋白一端通过连接多个组蛋白与凝胶结合,其另一端的多肽功能区暴露,这样当待测DNA片段通过时,含有甲基化位点的DNA即与MBD多肽牢固结合。在Masahiko Shiraishi等的研究中还发现,甲基化位点的数目是决定MBD柱结合力的最主要因素,而且,甲基化的密度也对其有重要的影响,也就是说,相同长度的DNA片段中甲基化位点密度越高,其结合力就越强[50]。
这种方法的优点是:1.是一种高通量的检测方法;2.可对未知片段进行初筛,选出的含有甲基化的片段进一步检测以发现新的甲基化位点;3.方法快速、简便。缺点是:1.一些DNA片段的特殊构型也可与MBD柱相结合,造成MBD非特异性捕获而引起假阳性(如:EcoRⅡ可与MBD结合);2.是一种定性而非定量的方法;3. 由于MBD柱中所含多肽的量不完全相同,因此,使用不同的MBD柱或单个柱经多次使用得到的分离产物之间会存在差异[50]。
2.3.3 联合甲基化敏感性限制性内切酶的MBD(Combination of methylated-DNA precipitation and methylation-sensitive restriction enzymes,COMPARE-MS)
Srinivasan Yegnasubramanian 2006年[55]报道了一种新技术COMPARE-MS,该法将MBD柱层析法与MS-RE联用,互补了各自单用的弊处,能够快速、敏感的检测DNA甲基化情况,可用于临床标本检测,作为早期诊断和肿瘤分级的依据[56]。其过程是:用非待测区的内切酶和甲基化敏感的限制性内切酶同时消化DNA片段,随后通过MBD柱捕获,保留了含有甲基化区的片段,最后通过实时PCR扩增定量分析(见图9)。
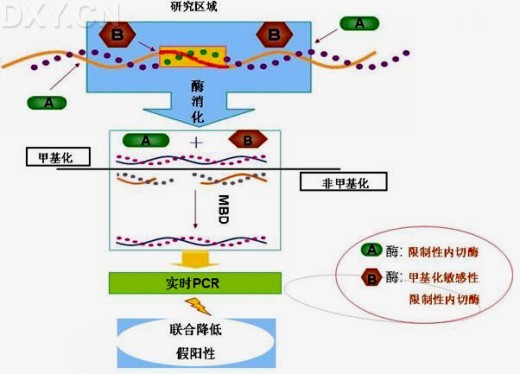
图9:联合甲基化敏感性限制性内切酶的MBD(COMPARE-MS)示意图。用甲基化以外的位点的内切酶(A酶)与甲基化敏感的内切酶(B酶)联用,则甲基化的DNA链不被切开,非甲基化的切开,再行MBD捕获存在甲基化位点的DNA片段,最后行实时PCR扩增并分析;这就避免了因仅用内切酶(A酶+ B酶)而不用MBD捕获时由于内切酶消化不完全而引起假阳性的问题,同样避免了单用MBD时由于非特异性捕获而引起的假阳性(图9参考引文[55]并略加修改)。
这种方法联合运用了MBD柱层析法及MS-RE法,这就避免了单用MBD引起的非特异性捕获及MS-RE不完全消化引起的假阳性的问题。因此,在快速、简便检测的同时,亦保证了结果的特异性和敏感性。缺点是:需要使用限制性内切酶,因此不同程度地受到内切酶识别位点的限制。
研究甲基化的方法之多,从一个方面说明了甲基化研究难度之大,也从另一个方面说明这些方法都存在着一定的限制。面对具体问题,选择最合适的解决方法就显得尤为重要。首先,根据研究目的选择合适方法:是研究整体水平的甲基化还是特定位点的甲基化,或是要发现全基因组中新的甲基化位点;其次,根据客观条件筛选方法,如:目标的序列是否已知,是定量研究还是定性研究,样本来源及数量如何,是否需要高通量的样本检测方法;最后,全面分析,选取敏感、可靠、经济、简便的方法,以达到理想的效果。随着甲基化研究的不断深入,甲基化分析技术将逐步完善。完善的研究技术将提供强有力的技术支持,从而为表观遗传、胚胎发育、基因印记及肿瘤研究提供一些新的思路。
参考文献:
[1]Wu C T, Morris J R. Genes, genetics and epigenetics: a correspondence [J]. Science, 2001, 293: 1103-1105.
[2]黄庆, 郭颖, 府伟灵. 人类表观基因组计划[J]. 生命的化学,2004, 24(2): 101-102.
[3]Dahl C, Guldberg P. DNA methylation analysis techniques [J]. Biogerontology, 2003, 4(4): 233-250.
[4]董玉玮,侯进慧,朱必才等. 表观遗传学的相关概念和研究进展[J]. 生命的化学, 2005, 22(1): 1-3.
[5]武立鹏, 朱卫国. DNA甲基化的生物学应用及检测方法进展[J]. 中国检验医学杂志, 2004, 27(7): 468-474.
[6]Riggs A D, Jones P D. 5-methylcytosine, gene regulation and cancer [J]. Adv Cancer Res, 1984, 40: 1-30.
[7]Bird A P. CpG-rich islands and the function of DNA methylation [J]. Nature, 1986, 321: 209-213.
[8]Cottrell S E. Molecular diagnostic applications of DNA methylation technology [J]. Clin Biochem, 2004, Jul, 37(7): 595-604.
[9]Jones P A, Baylin S B. The fundamental role of epigenetic events in cancer [J]. Nat Rev Genet, 2002, Jun. 3(6): 415-28.
[10]张永彪,褚嘉祐. 表观遗传学与人类疾病的研究进展 [J]. 遗传, 2005, 27(3): 466-472.
[11]Feinberg A P, Tycko B. The history of cancer epigenetic [J]. Nat Rev Cancer, 2004, 4(2): 143-153.
[12]黄琼晓, 金帆, 黄荷凤. DNA甲基化的研究方法学 [J]. 国外医学遗传学分册, 2004, 27(6): 354-358.
[13]Nuovo G J, Plaia T W, Belinsky S A, et al. In situ detection of the hypermethylation- induced inactivation of the p16 gene as an early event in oncogenesis [J]. Proc Natl Acad Sci USA, 1999, 96: 12754-12759.
[14]Soares J, Pinto A E, Cunha C V, et al. Global DNA hypomethylation in breast carcinoma: correlation with prognostic factors and tumor ptogression [J]. Cancer, 1999, 85: 112-118.
[15]Shinichi Toyooka, Nobuyoshi Shimizu. Models for studying DNA methylation in human cancer: a review of current status [J]. Drug discovery today: Disease Model, 2004, 1(1): 37-42.
[16]Cui H, Horon I L, Ohlsson R, Hamilton S R, Feinberg A P. Loss of imprinting in normal tissue of colorectal cancer patients with microsatellite instability [J]. Nat Med Nov, 1998, 4(11): 1276-80.
[17]Uhlmann K, Rohde K, Zeller C, et al. Distinct methylation profiles of glioma subtypes. [J] Int Cancer, 2003, Aug. 10, 106(1): 52-59.
[18]Kuo K C, McCune R A, Gehrke C W, et al. Quantitative reversed-phase high performance liquid chromatographic determination of major and modified deoxyribonucleosides in DNA [J]. Nucleic Acids Res, 1980, 8: 4763-4776.
[19]Fraga M F, Uriol E, Borja D L, et al. High-performance capillary electrophoretic method for the quantification of 5-methyl 2-deoxycytidine in genomic DNA: application to plant, animal and human cancer tissues [J]. Electrophoresis, 2002, 23: 1677-1681.
[20]Oefner, P J, Bonn G K, Huber C G, et al. Comparative study of capillary zone electrophoresis and high-performance liquid chromatography in the analysis of oligonucleotides and DNA. [J]. Chromatogr, 1992, 625(2): 331-3401.
[21]邓大君, 邓国仁, 吕有勇等. 变性高效液相色谱法检测CpG岛胞嘧啶甲基化 [J].中华医学杂志, 2001, 80(2), 158–1611.
[22]Wu J, Issa J, Hermen J, et al. Expression of an exogenous eukaryotic DNA methyl transferase gene induces transformation of NIN3T3 ceils [J]. Proc Natl Acad Sci USA, 1993, 90(19): 8891–8895.
[23]Oakeley E J, Podesta A, Jost J P. Developmental changes in DNA methylation of the two tobacco pollen nuclei during maturation [J]. Proc Natl Acad Sci USA, 1997, 94: 11721–11725.
[24]Oakeley E J, Schmitt F, Jost J P. Quantification of 5-methylcytosine in DNA by the chloroacetaldehyde reaction [J]. Biotechniques, 1999, 27: 744-6,748-50,752.
[25]Frommer M, McDonald L E, Millar D S, et al. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands [J]. Proc Natl Acad Sci USA, 1992, 89: 1827–1831.
[26]朱燕. DNA的甲基化的分析与状态检测 [J]. 现代预防医学, 2005, 32(9): 1070-1073.
[27]沈佳尧, 侯鹏, 祭美菊等. DNA甲基化方法研究现状 [J]. 生命的化学, 2003, 23(2): 149-151.
[28]Herman J G, Graff J R, Myohanen S, et al. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands [J]. Proc Natl Acad Sci USA, 1996, Sep 3. 93(18), 9821-9826.
[29]Kuppuswamy M N, Hoffmann J W, Kasper C K, Spitzer S G, Groce S L, Bajaj S P. Single nucleotide primer extension to detect genetic diseases: experimental application to hemophilia B (factor IX) and cystic fibrosis genes [J]. Proc Natl Acad Sci USA, 1991, 88: 1143–1147.
[30]Gonzalgo M L, Jones P A. Rapid quantitation of methylation differences at specific sites using methylation-sensitive single nucleotide primer extension (Ms-SNuPE) [J]. Nucleic Acids Res, 1997, 25: 2529–2531.
[31]Xiong Z, Laird P W COBRA: a sensitive and quantitative DNA methylation assay [J]. Nucleic Acids Res, 1997, 25: 2532–2534.
[32]Maekawa M, Sugano K, Kashiwabara H, et al. DNA methylation analysis using bisulfite treatment and PCR-single-strand conformation polymorphism in colorectal cancer showing microsatellite instability [J]. Biochem Biophys Res Commun, 1999, 262: 671–676.
[33]Cariello N F, Scott J K, Kat A G, et al. Resolution of a missense mutant in human genomic DNA by denaturing gradient gel electrophoresis and direct sequencing using in vitro DNA amplification: HPRT Munich [J]. Am J Hum Genet, 1988, May, 42(5): 726-34.
[34]Abrams E S, Stanton V P. Use of denaturing gradient gel electrophoresis to study conformational transitions in nucleic acids [J]. Methods Enzymol, 1992, 212: 71-104.
[35]Aggerholm A, Guldberg P, Hokland M, et al. Extensive intra- and interindividual heterogeneity of p15INK4B methylation in acute myeloid leukemia [J]. Cancer Res, 1999, 59: 436-441.
[36]黄庆, 府伟灵. DNA甲基化分析技术 [J]. 中国实验诊断学, 2005, 9(2): 304-306.
[37]Worm J, Aggerholm A, Guldberg P. In-tube DNA methylation profiling by fluorescence melting curve analysis [J]. Clin Chem, 2001, 47(7): 1183-9.
[38]Eads C A, Danenberg K D, Kawakami K, et al. MethyLight: a highthroughput assay to measure DNA methylation [J]. Nucleic Acids Res, 2000, 28: E32.
[39]范保星. DNA甲基化检测方法 [J]. 国外医学遗传学分册, 2002, 25(2): 99-101.
[40]Yan P S, Chen C M, Shi H, et al. Dissecting comples epigenetic alterations in breast cancer using CpG island microarrays [J]. Cancer Res, 2001, 61(23): 8375-8380.
[41]Huang T H, Perry M R, Laux D E. Methylation profiling of CpG islands in human breast cancer cells [J]. Hum Mol Genet, 1999, 8: 459-470.
[42]Gitan R S, Shi H, Chen C M, et al. Methylation-specific oligonucleotide microarray: a new potential for high-throughput methylation analysis [J]. Genome Res, 2002, 12: 158–164.
[43]Clement G., Benhattar J. A methylation sensitive dot blot assay (MS-DBA) for the quantitative analysis of DNA methylation in clinical samples [J]. Clin Pathol, 2005, Feb. 58(2): 155-8.
[44]Schouten J P, McElgunn C J, Waaijer R, et al. Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification [J]. Nucleic Acids Res, 2002, Jun 15, 30 (12): e57.
[45]Nygren A O, Ameziane N, Duarte H M, et al. Methylation-specific MLPA (MS-MLPA): simultaneous detection of CpG methylation and copy number changes of up to 40 sequences [J]. Nucleic Acids Res, 2005, Aug 16, 33 (14): e128.
[46]Costello J F, Fruhwald M C, Smiraglia D J, et al. Aberrant CpG-island methylation has non-random and tumour-type-specific patterns [J]. Nat Genet, 2000, Feb, 24(2): 132-8.
[47]Huang T H, Laux D E, Hamlin B C, et al. Identification of DNA methylation markers for human breast carcinomas using the methylation-sensitive restriction fingerprinting technique [J]. Cancer Res, 1997, Mar 15, 57(6): 1030-4.
[48]Frigola J, Ribas M, Risques R A, et al. Methylome profiling of cancer cells by amplification of inter-methylated sites (AIMS). Nucleic Acids Res, 2002, Apr 1. 30(7): e28.
[49]Hatada I, Hayashizaki Y, Hirotsune S, et al. A genomic scanning method for higher organisms using restriction sites as landmarks [J]. Proc Natl Acad Sci USA, 1991, 88: 9523-9527.
[50]Shiraishi M, Sekiguchi A, Oates A J, et al. Methyl-CpG binding domain column chromatography as a tool for the analysis of genomic DNA methylation. Ana Biochem, 2004, Jun 1, 329(1): 1-10.
[51]Meehan R R, Lewis J D, McKay S, et al. Identification of a mammalian protein that binds speciWcally to DNA containing methylated CpGs [J]. Cell, 1989, 58: 499-507.
[52]Bird A. DNA methylation patterns and epigenetic memory [J]. Genes Dev, 2002, 16: 6-21.
[53]Bird A P, Wolffe A P. Methylation-induced repression-belts, braces, and chromatin [J]. Cell, 1999, 99: 451-454.
[54]Lewis J D, Meehan R R, Henze W J, et al. Purification, sequence, and cellular localization of a novel chromosomal protein that binds to methylated DNA [J] Cell, 1992, 69: 905-914.
[55]Yegnasubramanian S, Lin X, Haffner M C, et al. Combination of methylated-DNA precipitation and methylation-sensitive restriction enzymes (COMPARE-MS) for the rapid, sensitive and quantitative detection of DNA methylation [J]. Nucleic Acids Res, 2006, Feb 9, 34(3): e19.
[56]Hendrich B, Bird A. Identification and characterization of a family of mammalian methyl-CpG binding proteins [J]. Mol Cell Biol, 1998, 18: 6538–6547.
Review and estimation of methylation technology
GU Ting-Ting1.2, ZHANG Zhong-Ming1, ZHENG Peng-Sheng1.2.3
1. Department of Gynecology and Obstetrics, the First Hospital of Xi’an Jiaotong University Medical School, Shaanxi Xi’an 710061, China
2. Key Laboratory of Environment and Genes Related to Diseases, Xi’an Jiaotong University Medical School, Ministry of Education
3. Correspondence Author
Abstract: DNA methylation, a very important part in epigenetics, has been playing a pivotal role in retaining normal cell functions, gene imprinting, embryo development, and human tumorigenesis, and now is one of hot area in medical researches. With increasing progresses in the methylation studies, a series of detecting techniques has been developed to match various requirements of methylation studies. All of these study methods can be divided into three groups: genome-wide methylation extent analysis, gene-specific methylation analysis and new methylated sites screening. In this article, we introduced most existing DNA methlylation detecting techniques and summarized their characteristics at the same time.
Key words: Epigenetics, DNA methylation, methylation detecting technique
![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)



![5-溴-4-氯-3-吲哚基β-D-葡萄糖苷酸钠盐[用于生物学研究],129541-41-9,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/874/0460612821870833081.jpg!wh200)