电泳迁移实验 EMSA
互联网
1 、核蛋白的提取
①用 细 胞 刮子刮取RAW264.7 细胞与VSMC ,移入2.5mlEP 管中。②将细胞用冰冷PBS 洗两遍,于4 ℃ , 5000g 离心3min ,沉淀细胞。③加5 倍细胞体积的冰浴缓冲液A 洗细胞一次,于4 ℃ ,5000g 离心3 min 沉淀细胞. ④加3 倍细胞体积的冰浴缓冲液A 悬浮细胞,冰上放置30 min 、剧烈振荡10 次,4 ℃ ,5000g 离心15min ,去上清,沉淀为细胞核。⑤加与细胞等体积的冰浴缓冲液B ,充分混匀,冰上放置30m in 后,于40 ℃ ,15 000g 离心15min, 上清为核蛋白。⑥取2ul 核蛋白Bradford 法测定核蛋白浓度,分装后于-70 ℃ 保存。
2. 探针的标记与纯化
A 、 探 针 的标记: 将以下试剂加入冰浴中的0.5m l 的EP 管中,总体积20 时。①未标记的探针:2ul (50ng); ② 10 x 激酶缓冲液:2g 1; ③ [y-32P]ATP: 4ul (40 uCi); ④T4 多聚核甘酸激酶:lul (10U); ⑤超纯水:11ul 。
B. 混匀后37 ℃ 水浴30 分钟;
C 、加入5u1 1%SDS/100 mM EDTA 短暂涡旋混匀,以终止激酶反应;
3 、探针的纯化
①准 备 MicroSpin' G25 分离柱; ②轻轻涡旋分离柱以重悬管内树脂; ③将盖子拧松1/4 后去掉管底密封; ④将分离管放入一只1.5mlEP 管中(EP 管作支撑用) ⑤ 735g 离心l 分钟; ⑥加入样品: ⑦分离管放入一只新的1.5 mlEP 管中,缓慢将样品加入树脂床角度平面的中央,735g 离心1 分钟; ⑧将75ul 超纯水加入分离柱,735g 离心1 分钟; ⑨收集支撑管内纯化好的探针,小心丢弃分离管。
4, 测定探针的放射活性
取1ul 纯化的探针,用闪烁计数器测量其放射活性,放射活性大于undefined 10 5 cpm/ul 示标记成功。
5, 凝胶迁移阻滞法测定NF-KB
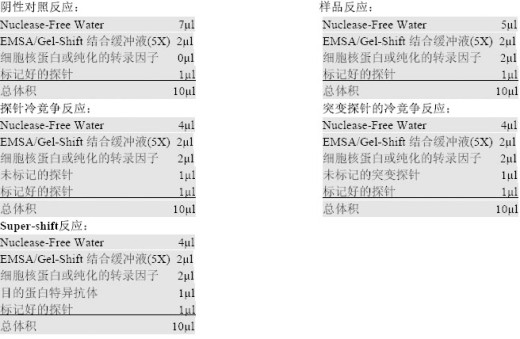
A 、 按下 列 顺序分别将各反应成分加入第一套做好标记的EP 管内: ①结合缓冲液:4ul ②稳定液D: 2 ul; ③核提取物:lug; ④去离子水至:16ul.
B 、用移液枪轻轻吸打混匀,4 0C 下将核提取物预孵育20 分钟,
C 、在核提取物预孵育期间,按下列顺序依次将各成分加入做好标记的第二套EP 管内: ①结合缓冲液:2ul; ②稳定液D:1ul; ③探针:lul; ④去离子水:4ul 。
D 、将探针棍合物加入预孵育好的核提取物混合物中,用移液器轻轻吸打混匀后,4 ℃ 继续孵育20 分钟。
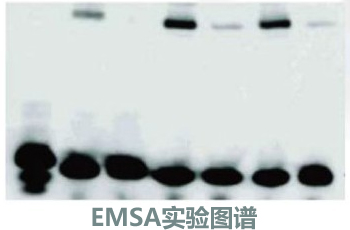
E,EMSA 测定: 预先将5% 非变性丙烯酞胺胶(38:2 ) 和电泳 缓冲液(1X TGE) 预冷至4 ℃ , 然后: ①将每反应管内所有反应物加入样品孔中。同时在一空白孔中加入含溟酚蓝的上样缓冲液,以观测胶的移动情况。当溟酚蓝电泳 至玻璃板下1/3 即可停止电泳 ( 约2 小时) 。②电泳 :12.5V/cm(16cm 玻璃板为200V)a
F 、放射自显影: 电泳 完毕后,取出凝胶,用保鲜膜封好; 将凝胶与放入有增感屏的曝光盒中,于一70 ℃ 放射自显影24 小时。然后将X 光片在显影液中显影30sec-1min ,在定影中定影15-30min ,清水冲洗干净后自然晾干。
G 、图像分析: 将各测量组的电泳 照片扫描至计算机,然后应用Bandscan 分析软件对电泳 条带进行灰度测定,并计算平均光密度值(OD) ,以各条带的OD 值表示相应核转录因子的活性