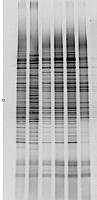
变性梯度凝胶电泳(DGGE)
互联网
3217
简 介
这个方法是应用最早也是最常用的突变筛查方法之一,在过去的十年中经历了很大的改进,并被诊断室所广泛使用,最近有篇关于该问题的综述(Fodde>和 Losekoot 1994 年)。
 原 理
原 理
如果 DNA 双链分子全长不断增加温度或用化学变性剂处理,两条链就会开始分开(解链)。首先解链的区域由解链温度较低的碱基组成。 G.C 碱基对比 A.T 碱基对结合得要牢固,因此 G. C 含量高的区域具有较高的解链温度。同时影响解链温度的因素还有相邻碱基间的吸引力(称作“堆积”)。解链温度低的区域,通常位于端部称作低温解链区( lower melting domain )。如果端部分开,那么双螺旋就由未解链部分束在一起,这一区域便称作高温解链( high melting domain ) ( 图 1) 。如果温度或变性剂浓度继续升高,两条链就会完全分开。变性梯度凝胶电泳法依据首要的一点是: DNA 双链末端一旦解链,其在凝胶中的电泳速度将会极剧下降(图 2 )。第二个根据是,如果某一区域首先解链,而与其仅有一个碱基之差的另一条链就会有不同的解链温度,因此,将样品加入含有变性剂梯度的凝胶进行电 泳就可将二者分开(图 3, 1 和 2 道)。最终,如果一双链在其低温解链区碱基错配(异源双链),而与另一等同的双链相比差别仅在于此,那么,含有错配碱基的双链将在低得多的变性剂浓度下解链。事实上,样品通常含有突变、正常的同源双链以及配对的异源双链,后者是在 PCR 扩增加时产行的。而含有错配的双链(图 3 中的 3 和 4 道)通常可以远远地与两个同源双链(图 3 中 1 和 2 道)分开,这种分离效果使该方法灵敏度很高。
泳就可将二者分开(图 3, 1 和 2 道)。最终,如果一双链在其低温解链区碱基错配(异源双链),而与另一等同的双链相比差别仅在于此,那么,含有错配碱基的双链将在低得多的变性剂浓度下解链。事实上,样品通常含有突变、正常的同源双链以及配对的异源双链,后者是在 PCR 扩增加时产行的。而含有错配的双链(图 3 中的 3 和 4 道)通常可以远远地与两个同源双链(图 3 中 1 和 2 道)分开,这种分离效果使该方法灵敏度很高。
 泳就可将二者分开(图 3, 1 和 2 道)。最终,如果一双链在其低温解链区碱基错配(异源双链),而与另一等同的双链相比差别仅在于此,那么,含有错配碱基的双链将在低得多的变性剂浓度下解链。事实上,样品通常含有突变、正常的同源双链以及配对的异源双链,后者是在 PCR 扩增加时产行的。而含有错配的双链(图 3 中的 3 和 4 道)通常可以远远地与两个同源双链(图 3 中 1 和 2 道)分开,这种分离效果使该方法灵敏度很高。
泳就可将二者分开(图 3, 1 和 2 道)。最终,如果一双链在其低温解链区碱基错配(异源双链),而与另一等同的双链相比差别仅在于此,那么,含有错配碱基的双链将在低得多的变性剂浓度下解链。事实上,样品通常含有突变、正常的同源双链以及配对的异源双链,后者是在 PCR 扩增加时产行的。而含有错配的双链(图 3 中的 3 和 4 道)通常可以远远地与两个同源双链(图 3 中 1 和 2 道)分开,这种分离效果使该方法灵敏度很高。
为使仅有一个碱基之差的不同分子取得最好的分离效果,必须先选择所要研究的 DNA 范围以及电泳样品时变性剂浓度梯度。这可以按图 2 所示的正交变性梯度实验进行经验性的解决。变性剂梯度应选在曲线斜率大的部分,因为这时多数分子处于部分变性状态这使得落入低温解链区的不同分子达到最佳分离。

为防止对患者样品分析之前对目标 DNA 片段的经验性分析占去大量时间,已在本技术的改进人 Leonard Lerman 的实验室设计了一项计算机程序,程度名叫 MELT87 和 SQHTX ,它可以模拟和任何已知序列 DNA 解链温度有关的解链行为。以碱基序列为基础,程序可以给出解链图象。作为实例血红蛋白基因的解链图如图 4 所示。程序还可给出最佳凝胶电泳时间以及任何碱基改变对解链图象产生的预期影响。 MELT87 程序还可以决定是否将多聚 GC 加到 3’ 或 5’ 端的引物上。
现在多数分析是用所谓的“ GC 夹板”( clamp )技术进行的(见下文)。它是将一段长度为 30-50 碱基,富含 GC 的 DNA 附加到双链的一端以形成一个人工高温解链区。 这样,片段的其他部分就处在低温解链区从而可以对其进分析。这一技术使该方法可检测的突变比例大大增加。
该方法的发展经过
该方法的主要发展阶段见表 1 ,其中许多操作今天已普遍使用。本表仅列出该方法的主要的发展经过,包括使用异源双链“ GC 夹板”技术, PCR 及专门的计算机程序等。 PCR 反应技术的问世使非标记技术简便了许多。
表 1 变性梯度凝胶电泳的发展经过
| 1979 | 电泳系统发明 | Fisher 和 Lerman1979 年 |
| 1983 | 分离仅有一个碱基之差的 DNA 双链 | Fisher 和 Lerman1983 年 |
| 1985 | 于基因组 DNA 中检测出一地中海贫血突变 | Myers 等 1985 年 |
| 使用异源双链技术 | Myers 等 1985 年 | |
| 首次使用“ GC 夹板”技术 | Myers 等 1985 年 | |
| 1987 | 预测解链行为及分析用计算机程序出现 | Lerman 和 Silverstein1987 年 |
| 1989 | “ GC 夹板”技术与 PCR 技术相连接 | Sheffield 等 1989 年 |
| 非标记检测法问世 | Sheffield 等 1989 年 |
本方法的不同形式
(a) 分析模式。变性剂由甲酰胺 / 尿素变为温度梯度。一种方法为温度梯度凝脉电泳( TGGE ),即在电泳板上保持一温度梯度,除此而外原理相同。另一方法称为“温度横扫型凝胶电泳( temperature sweep gel electrophoresis )”。这回,在电泳过程中逐渐统一提高胶板温度。在这两个方法中,化学变性剂的浓度在凝胶上保持衡定(这和通常不断增高的梯度不同)。而且由于可以避免“缓冲液储积”现象,所以显然这样做是有优点的。(而“经典”的分析方法是在“缓冲液储积”情况下进行的)。其他形式都是以电泳时条件不变为基础。在溶液解链一法中,双链在含有阶梯式升高的变性剂溶液中解链,然后用标准的非变性聚丙烯酰胺凝胶电泳方法对解链情况进行分析。在恒变性剂凝胶电泳( CDGE )(凝胶中的变性剂浓度一致)法中,对待分析片段的分离是在和该片段低温解链区相应的变性剂浓度之下进行的。但这意味着每种待分析片段需要不同的电泳条件,而且该方法可能会在 DNA 片段中检出未知突变。但除了此方法的发明者及其合作者的实验外,其他实验室很少使用这一方法。直到最近才由于毛细管电泳( Khrapko 等 1994 年)的引入而使其转向分析应用,并称作恒变性剂毛细管电泳( CDCE )。它是在使双链刚开始解链时的恒定化学变性剂和温度条件下进行分析工作的。毛细管中填充以线性梯度丙烯酰胺( linear acrylamide ),由激光探测系统检测标荧光物质的 DNA 分子。该检测系统快速灵敏可以在 30,000 个碱基序列中检出一个突变,但如果要对另一不同片段进行分析,前面的条件就必须改变。
每次分析的序列数量在增加。为了用最小量的电泳分析对更长 DNA 片段作突变和多态性筛查,在过去的一段时间里人们已经作了大量努力,其中一则很好的例子是可以将其用于未扩增的人类基因组 DNA ( Gray 1992 年)。一个实验用 4 种碱基切割酶之一对 DNA 进行消化,然后用变性梯度凝胶电泳技术电泳、迎迹转移。用放射性物质标记的 DNA 探针对 DNA 进行检测。因为使用了“ GC 夹板”技术或异源双链技术,所以该方法可用多种探针对薄膜进行多次检测。虽然此实验只检测出了 60% 的突变,但可用另外其他酶对此作部分补偿。用第一种酶检测不出位于高温解链区的突变,但或许用另一种酶作用时可使其落入低温解链区从而得以检测。更深入的一次筛查更多 DNA 的方法有如对 CFTR 基因( Costes 等 1993 年)的特定外显子进行多种途经分析,将多个样品加到一个电泳道上电泳。另一方法对此作了更大的改进,将苯丙氨酸羟化酶基因的外显子放在同一凝胶条件的不同电泳道上电泳,而不是将 13 个外显子放到不同凝胶条件下泳( Guldberg 和 Guttler1994 年)。这一方法称作宽幅度变性梯度凝胶电泳( broadrange DGGE )。因此用该方法筛查患者突变将会节约一大笔花费(图 5 )。将基因组或基因片段分离后进行变性梯凝胶电泳再在另一方向上进行普通电泳同样可以在一次分析中检查更多的 DNA ( Uitterlinden 和 Vijg 1994 年)。
(c)其他改进。在 PCR 反应过程中加入“ GC 夹板”( Top1992 年)而不是应用含有“ GC 夹板”的特定引物,这一方法也有可能减少耗费。由一端进行 PCR 反应的引物有:带有 15bp 碱基接头的引物和由 15bp 接头和 35bp “ GC 夹板”构成的接头 / 夹式引物。当然这就要求一个用特定引物扩增,另一个用带有“夹板”的引物扩增,而且要用校读多聚酶( Proof reading polymerase )以防止引入人为突变。
去除“ GC 夹板”或用化学“夹板”代替可能都会使操作简便( Costes 等 1993 年 a ; Fernandez 等 1993 年)。此外,“ GC 夹板”由连接补骨脂的多个碱基 A 替代,经过扩增,它就会与新加上去的配对碱基 T 结合在一起,经光照射后与末端共价连接在一起。现已对此方法进行了深入的研究( Costes 等 1993 年 b )。 DNA 片段中特定突变通常会产生特定的异源双链和同源双链图,所以检测人员要能够区分所检测到的突变是否为以前所描述的突变。但是,两个或更多突变产生的双链图可能比较相像,所以要确定检测出的突变是否为新发现的突变,就可以通过再次分析前加入已知突变样品( Guldberg 和 Guttler1993 年)而予以解决。如果已知突变与所检测到的突变相同,那么就会产生复合双链图,这种方法可以不用进行序列分析而对突变做出鉴定。
Russ 和 Medjugorac(199 年 ) 报道用恒温平板代替了培养槽。
最后,从安全角度出发,Guldberg等人(1994年)介绍了一种方法,将甲酰胺从恒变性剂凝胶电泳中去掉,他们还推测可以将变性剂从变性梯度凝胶电泳中去掉。
从此方法发展早期开始,RNA:RNA和DNA:RNA双链就被不时地用来进行分析研究。

突变检出率
运用计算机程序从本方法原理第一条出发可以估计出检出率,或者用此方法去检测大量突变也可以估计出检出率。这两种方法得到的答案可能不一致,因为,比如说DNA分子周围序列对检测结果有影响。
估计突变检出率的研究方法有两种类型:(a)用盲法检测100个左右的突变,至少包括所有突变类型中的两类,(b)对一群基因确有突变的患者进行检测,(c)未检突变的记录。所以至少能从三个层次来讨论变性梯度凝胶电泳的突变检出率问题。不过,随着检测方法的发展整个检出率提高了(表3)。
表3 变性梯度凝胶电泳的突变检出率,自Cotton(1994年a) 改写
| 方 法 | 样 品 | 检 出 率 |
| 无“GC夹板” | 多种 | 50-70% |
| 同源双链加“GC夹板” | 130个碱基对中的450个突变 | 95% |
| 异源双链加“GC夹板” | β血红蛋白基因 | “实际上全部” |
应用“ GC 夹板”变性梯度凝胶电泳技术研究雌激素受体基因时,有一研究小组报道外显子 1 含有 70%GC 碱基,因为 CpG 区是突变热点,所以必须用单链构象多态技术进行大量的筛查( Roodi 等 1995 年)。
对特定基因突变的患者进行检查,应用异源双链技术和“ GC 夹板”技术,按照所推荐的方法进行检测,现在已经清楚如果有突变存在,那么几乎毫无遗漏地被检出来。例如,在一项对 44 例血友病 B 患者所作的研究中, 40 例患检出潜在缺陷,用序列测定法或变性梯凝胶电泳法在其余 4 例中没有检出突变。应用此方法分析 308 例丹麦苯丙酮尿症患者染色体,检出了 99% 的等位基因突变(其中 32 例为单碱基突变, 3 为例缺失突变)( Guldberg 等 1993 年)。在轻型或缓和型血友病 A 的例子里,检测出 26 例已知点突变,用 45 对引物对 99% 的编码序列进行扩增,检测出了所有突变( Higuchi 等 1991 年)。在 29 例患者中检出了 25 例突变(检出率为 86% ),不过其他突变可能位于未被检测的区域(例如内含子)。
对用带有 GC 夹板的异源双链变性梯度凝胶电泳分析所遇到的假阴性问题(即漏掉突变)比较难以找到准确的原因,但如果用来检测已知突变,那就变得显而易见了。在 7 例次黄嘌呤鸟嘌呤磷酸核糖基转移酶( HGPRTase )突变实验中, CDGE (恒变性剂凝胶电泳)法漏掉了一例突变,令人惊讶的是,“ GC 夹板” DGGE 法漏掉了 4 例突变( Hovig 等 1991 年)。“宽幅度”( broad range ) DGGE 也被用上去了,所以不清楚是否选用不同引物就可以使这 4 例突变分开,或是因为 DNA 前后序列影响对突变的检测。在因子Ⅷ基因 GC 堆积的 371bp 片段中报道了同一密码子上另外的 4 个假阴性突变( Traystman 等 1990 年),但当该片段降解为 236bp 长的片段后就易于检测了。
看来尚无假阳性的报道,应该注意到可能会检测出甲基化的碱基(见 Cotton 1992 年 a )。
总之,看来使用 DGGE 结合“ GC 夹板”技术以及使用异源双链技术都可检出近 100% 的突变,但不能说这 100% 检出率是由于假阴性得到了证明。这近乎 100% 的检出率已使此方法成为寻找未知突变的诊断室和许多实验室的首选方法。
灵敏度
对于遗传性疾病,在给一定位点(该位点突变为杂合状态)野生型占 50% 的情况下,一个方法要能检测出 50% 的突变碱基。然而如果要研究嵌合体或癌症,就必需有更加灵敏的方法,因为这时突变分子所占的比例降低了很多。对于检测癌症中小量的残存性病灶这一点特别正确,要尽可能检测出最小数量的突变分子。
在 DGGE 法中,突变的同源双链分子和另两种互补异源双链分子完好无损,分离后可用于定量分析和进一步进行其它分析,如测序(而裂解法破坏突变分子)。在某些特定情况下 DGGE 法可以从 100bp 长的序列中检测出 0.5% 的突变分子(见 Khrapko 等 1994 年)。如果用 CDGE (见前文)法进行分离,分离工作用毛细管电泳完成,通过激光诱生的荧光进行探测,这时可以从 206bp 长的片段中检测出 0.03% 或 1/3000 的突变分子( Khrapko 等 1994 年)。在检测残留的癌细胞方面,这一方法应该很有用。
突变和邻近序列效应( context effects )
到目前为止,已对不同邻近序列( contexts )中 DNA 链间所有可能的单碱基差异进行了研究,但没有对影响检测的因素作大规模系统的研究。有一项研究使用 TGGE (温度梯度凝胶电泳)技术检查最邻近序列对单碱基错误配对稳定性的影响( Ke 和 Whartell 1993 年)。错误配对的邻近序列可能会影响检测从而象报道所说的那样使突变漏掉了。
优点和缺点
通常所用 DGGE 法的优缺点见表 4 。尽管有这些缺点,但如决定要用, DGGE 法还不失为一种快速、无放射性的好方法,有 99% 的把握从外显子大小的 DNA 片段中检测出突变分子。
表 4 DGGE 法的优缺点
| 优点 | 几乎可以检出所有突变 |
| 可将突变分子完好无损地同野生型分子分开用于进一步的分析 | |
| 无须标记 | |
| 电泳前只需一步操作 | |
| 可用于未经扩增的基因组 DNA | |
| 可检测出象甲基化这样的 DNA 修饰 | |
| 缺点 | 需要专门设备 |
| 需要用计算机对序列进行分析,需要进行预实验 | |
| 需要昂贵的“ GC 夹板” | |
| 无法确定突变在 DNA 片段中位置 | |
| 需要用含有毒性物质甲酰胺的梯度凝胶 | |
| DNA 片段大小限制在 100-500bp |
本方法的发展前景
由于 DGGE 法突变检出率高,所以该方法可能已被诊断室用了一段时间了,如果用不同的 DGGE 技术加上“ GC 夹板”方法在一块胶上可以筛查几千 bp 长的片段。按照筛查模式来讲,那将是比较理想的。从诊断角度考虑,理想的方法是在一块胶上筛查一位患者所有的外显子而不是对每一个外显子用不同的胶板。 Guldberg 和 Guttler(1994 年 ) 的“宽幅度”( broad range )凝脉电泳将来可能会受人青睐,但都可能使突变检出率有所损失,因此,“化学夹板”法可能会被广泛使用。
从两个方向上使用 DGGE 技术对于检查整个基因组( Uitterlinden 和 Vijg1994 年)和肿瘤诊断( Verwest 等 1994 年)可能会更加重要。同时,将 DGGE 法用于自动化测序仪也有可能。
主要应用
Fodde 和 Losekoot ( 1994 年)的综述给出了 DGGE 技术的大量应用。但,一些主要的应用在表 5 中给出。 DGGE 技术不仅可用于癌症和遗传病的筛查及诊断,而且,在癌症(残存性病灶、突变图谱研究等)突变定量实验中还用以检测少数突变等位基因。最近有人用来检测β-地中海贫血,见图 6 。已有人将大约 150 多个应用列了出来( BioRad 实验室 1994 年)。
表 5 DGGE 法十种新近的主要应用
| 基 因 | 疾病 | 方 法 | 参阅内容 |
| 线粒体 DNA | 筛查 | Yoon 等 1991 年 | |
| 因子Ⅷ基因 | 血友病 A | 筛查 | Higuchi 等 1991 年 |
| APC | FAP | 筛查 | Fodde 等 1992 年 |
| CFTR | 胆囊纤维化 | 筛查 | Ferec 等 1992 年 |
| PAH | 苯丙酮尿症 | 筛查 | Guldberg 等 1993 年 |
| c-Ki ras | 密码子 12 (鼠) | 定量 | Soman 和 Wogan1993 年 |
| p53 | 急性白血病 | 筛查 | Pignon 等 1994 年 |
| β血红蛋白基因 | β地中海贫血 | 诊断 | Dozy 和 Kan1994 年 |
| RBI | 成视网膜细胞瘤 | 筛查 27 个升显子 | Blanquet 等 1995 年 |

| Hmshi | HNPCC | 筛查 16 个外显子 | Wijnen 等 1995 年 |
简要操作步骤
下面是用最常用的方法(即筛查外显子)分析 DNA 片段的操作梗概,其同时使用了“ GC 夹板”和异源双链技术。
步骤 1 仪器设备。已在很多场合下对此有所叙述(见下文),但也可以由研究者通过商业途径获得或自己制做。简要地讲,把凝胶灌到盒子里然后放入大的加热培养槽中,加入经充分搅拌的缓冲液。然后,将一个电极(阳极)与这个缓冲液相连,另一个电极(阴极)与上端的缓冲液相接,它可以将凝胶顶部与培养槽或低处缓冲液隔开。现在需要用一个小泵将缓冲液由外面(低处)泵到高处以抵消上端缓冲液向下面的流失。
步骤 2 对样品序列进行分析为筛查作准备。由于使用“ GC 夹板”技术可使多数突变落入低温解链区,所以用计算机程序选择最佳引物位置就非常重要了,但仍需决定对哪一端连接“ GC 夹板”较好。大多检测对外显子和一些内含子的序列都进行了分析,因为多数突变位于外显子中,而外显子的大小多在 100-400bp 范围内,所以可以有效地检测出突变分子。一旦基因组 DNA 引物位置确定,电泳条件就可由以下两步确定。( a )使用 SQHTX 程序(另一个程序 MELT87 用于预测解链区,可作为校对,但如果使用了“ GC 夹板”就无须使用此程序。)这些程序可从 L. Lerman 博士那里得到。( b )对样品进行正交凝胶电泳,见图 2 ,选择曲线陡峭部分两端作为梯度凝胶的化学变性剂浓度范围。
步聚 3 样品制备。用两个引的对基因组 DNA 进行扩增,一个引物的 5’ 端连以 40-45bp 富含 GC 的一段序列。因为必须有异源双链形成才能保证检出率接近 100% ,但由于可能形成突变纯合子,所以必须加入等摩尔正常 DNA 分子,以在分析前形成异源双链。
步聚 4 制胶。制胶时要选择梯度范围,这可用梯度混合器完成,两个容器分别放有变性剂的极端浓度和合适浓度的丙烯酰胺。
步聚 5 电泳。经过电泳和溴化乙锭染色可以很好地分辩 1-2ug 样品。当温度平衡到 60 ℃后,移去梳子,加入混合有缓冲液的样品,电压控制在 60 到 160V 之间,电泳完后,以标准方法用溴化乙锭染色。
分析所花时间
PCR 扩增需要几小时,凝胶准备 1 小时,电泳 3-6 小时,染色几分钟。因此 ,一项检测分析仅需 7 小时,接到样品 24 小时后分析就可完成分析工作。
操作步骤参考文献
以下参考文献,以多种不同的模式详细说明了如何购买或制作这些装置以及如何检测分析样品,从当前通用的改进方法应用时起,所有方法都写进了这些参考文献。
1.Dlouhy等 1991 年。简要叙述了检测方法,实验装置和所用溶液。
2.Abrams 和 Stanton1992 年。从发展这一方法的实验室角度,详细地描述了该方法的原理及实际操作,而且给出了综述所参考的文献,所以可能是本方法的权威性叙述。
3.Hovig等 1994 年。这是一本有关人类遗传学方法手册中的一个单元,详细地对 DGGE 法和不太常用的 CDGE 法做了说和明评论。