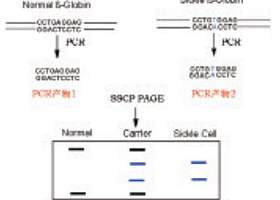
PCR-SSCP
互联网
一. 样品的制备
1. 设计引物。用Oliga6.0对目的基因进行分析,设定引物,引物长度18-21个碱基,扩增片段以200-300bp最为合适。
2. PCR扩增并检测。根据不同的引物挑选适合的退火温度进行PCR扩增。扩增产物用2-2.5%的琼脂糖胶跑水平电泳检测,上样量3-5ul。PCR产物为10ng/nl左右为最佳。
3. PCR产物与变性buffer混合。在干净的PCR管底部加入5ulSSCP上样缓冲液(变性缓冲液,同《分子克隆》中的测序缓冲液),然后在缓冲液中央加入PCR扩增产物。按照经验,扩增效果在琼脂糖胶上能看出比较亮的带的样品加1ul,效果很好加0.5ul,如果不太好就适当增加1.5、2或3不等,同时加大上样缓冲液的量,比如加3ul的PCR产物,缓冲液加到8ul变性效果更好。
4. PCR产物变性。加好的样品进行离心,使样品集中在管底。PCR仪上95变性5-10分钟,立即取出PCR产物连同架子一同置于冰上静置5min,以免变性的产物复性。
~undefined注:3和4步可以在制SSCP胶第四步后,等胶凝的过程中进行。
二. 制胶
1. 装板。在所要进行实验的每一副玻璃板(事先洗静、风干)的两边及底部装上垫片,尽量使底边及侧边紧密接触,夹子固定好,用0.8-1%的琼脂糖封边,确保接头处都封上以免漏胶。
2. 配胶。根据不同长度的PCR片段配置适合浓度的胶。最适合的胶浓度是经过多次的摸条件得来的,根据经验,不同长度的片段可能适合的胶浓度建议如附录1。
3. 灌胶。配好胶后搅匀,灌入装好的玻璃板中,注意不能产生气泡,如果产生气泡把板立起,轻轻敲打可使气泡升出胶面,胶面与凹板上沿大约差0.5cm时插上梳子,要保证梳子齿和液面接触处没有气泡,一旦产生要拔出重插。
4. 静置。灌好的胶平放或与水平成一比较小的角度(100以下)静置水平桌面上30min左右使之充分聚合。
~undefined注:此时可以进行PCR样品变性,即第一部分的3、4步。
三. 上样
1. 安板。PAGE聚合好后要及时拔出梳子(时间耽搁长后会使梳子很难拔出),拔梳子时要用力均匀以保持胶孔的整齐。用夹子把胶板固定在电泳槽上,凹槽的一面朝里,安板时首先使板的底边一端先接触电泳液,再缓慢地过度到另一端,以免产生大气泡(产生大气泡会使电泳条带弯曲)。
2. 预电泳。从底槽把一些电泳液1×TBE吸到上槽,使液面高出玻璃板矮边1cm以上,并确保上槽不漏液。打开电源,大槽电压调到140-150V,小槽110-120V,预电泳10min左右。
3. 点样。用微量进样器把准备好的样品按顺序加到胶孔中。由于边缘效应带型不整齐,每块板中最边上的两个孔最好不要点样。
4. 电泳。大槽电压140-150V,小槽110-120V,恒温电泳10个小时以上。
四. 染色
1. 固定。把胶卸下,做好起始记号,放入70%乙醇中在摇床上固定15min。固定好后乙醇回收(可以重复使用5次左右),蒸馏水洗两遍,每遍3min左右。若同时染两块胶固定和洗脱都要适当增加时间。
2. 染色。染色液(200ml染色液含3.6%的NaOH4.2ml、20%AgNO33.6ml、氨水2ml)染色30min,同时染两块胶要适当增加时间,需40min左右。倒掉染色液,洗3遍,每遍3min,同时染两块胶要适当增加时间。
3. 显色。显色液(200ml显色也包含1%柠檬酸钠1ml,甲醛100ul)至清晰。倒掉显色液,加蒸馏洗脱3次停显。
附录
1. 不同长度的片段可能适合的胶浓度建议如下:
180-220bp左右 14%
250-280bp左右 13%
300-320bp左右 12%
360bp左右 10%
400bp以上 8%