T 细胞克隆的制备
互联网
1968
- 相关专题
基本原理
用限度稀释克隆形成法制备T 细胞克隆时,并非依赖细胞 的特性,而是将T 细胞在细胞培养 板上稀释到统计学的浓度,即从理论值上达到每孔1 个细胞,其中加入IL-2 和PHA 可增强细胞的生长,而加入的同种异体PBMC 作为饲养细胞,在这种体系中,单个T 细胞可增殖生长成细胞集团,即T 细胞克隆。
试剂和材料
●提纯T 细胞(参见第一章之第六节)
● 饲养细胞(以50GYγ射线照射):从两个不同供者获得的同种异体PBMC从理论上认为两者的每一演变均不同。
● 培养基:RPMI1640 培养液(RPMI1640 液+1mmol/L 丙酮酸钠+2mmol/L 谷氨酰胺+100u/ml青霉素和100μg/ml 链霉素)再加入热灭活的10%的AB 型血清。
● 按说明书所述,将PHA-A 溶于双蒸水中。
● 含有104u/ml hrIL-2 的PBS 液中加入1%牛血清白蛋白(BSA)。
● 器皿、仪器:96 孔U 型低细胞培养板及24 孔细胞培养板,垂直气流超净台,CO2 孵箱,倒置显微镜等。
实验操作
1.培养板的准备
1) 应用典型的有限稀释克
隆形成法,以0.5 个/孔、1 个/孔、5 个/孔等三种不同细胞浓度准备三块96 孔U 型培养板,以及半块
为10 个/孔浓度的96 孔培养板。
2) 准备含有5×105/ml 饲养细胞(经γ射线照射)的RPMI1640培养液,并加入20u/ml 的IL-2 和1μg/ml PHA-A。
3) 在3 块半96 孔板上,每孔均加入100μl 饲养细胞(50000个)。
4) 准备稀释T 细胞的培养(图2-3)
5) 如图2-3 所示,准备3 支15ml 试管,内含5ml 细胞培养液(CM)加20u/ml IL-2,将4 支试管分别稀释并接种96 孔板,步骤如下:
(1) 第1 管加50μl 稀释液C,相当50 个细胞,混匀后加在96 孔板上,50μl/孔,此板为0.5 细胞/孔。
(2) 第2 管加100μl 稀释液C,相当100 个细胞,混匀后加在96 孔板上,50μl/孔,此板为1 细胞/孔。
(3) 第3、4 管各加500μl 稀释液C,相当500 个细胞,第3 管为500 细胞/5mlCM,,混匀后加在96 孔板上,50μl/孔,此板为5 细胞/孔; 第4 管为500 细胞/2.5mlCM,,混匀后仅够加半个板,50μl/孔,此板为10 个细胞/孔。
4 块96 孔板上有50μl 不同浓度T 细胞悬液加到含有100μl 饲养细胞的各孔中(IL-2 的终浓度应为20u/ml)。
2.T细胞克隆培养
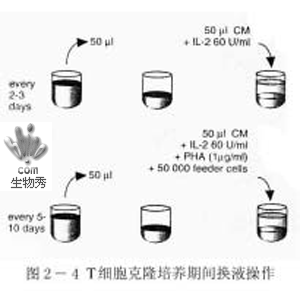
1) 如图2-4 所示,每隔2-3 天吸弃50μl培养上清液,加入50μl 含有IL-2 的新鲜培养液,使其终浓度达20u/ml;每隔10-15 天吸弃50μl 培养上清液,加入50μl 含有新鲜饲养细胞(50000/孔)、IL-2(终浓度达20u/ml)和PHA-A(终浓度达1μg/ml)的培养液。2) 经21-25 天后出现克隆细胞生长孔,首先在10 细胞/孔的板上出现,当在1 细胞/孔的板上出现克隆生长时,即可将5 细胞/孔和10 细胞/孔的两块板丢弃。
3) 当0.5 细胞/孔和1 细胞/孔两板上长出的细胞克隆变大时,将该孔的100μl 培养液悬浮混匀,分装于96 孔板2 个孔内,50μl/孔,而且每孔已预先加有上述饲养细胞(50000/孔)。
4) 随着细胞的继续生长,用同法可将同一克隆细胞分装扩充为4 孔,当分装成8 孔时,可汇总这8 孔的细胞转移至24 孔板的1 孔内。
5) T 细胞克隆可在如此条件下维持其生长,即每隔2-3 天更换含有IL-2(20u/ml)的新鲜培养液,每隔10-15 天更换含有新鲜饲养细胞、IL-2(20u/ml)和PHA(1μg/ml)的培养液,其中加入饲养细胞的比率应为T 细胞克隆细胞数0.5-1×106 细胞需106 饲养细胞。
质控与提示
1.细胞克隆的性能可用抗TCRVβ片段的抗体在流式细胞仪上进行检测,或用分子生物学方法(如RT-PCR)去检测TCR-Vβ转录产物。
2.最好在一检出阳性克隆时就开始进行亚克隆。
3.某些T 淋巴细胞亚群不能在这一系统(如饲养细胞+PHA 环境)中增殖,但此系统对获得克隆的总体要比接种细胞的数量更为有效。
4.必须使饲养细胞受到充分照射,以保证长出的细胞是T 细胞克隆,而不是饲养细胞。
(可用流式细胞仪、分子生物学方法或HLA 分型等检测)。