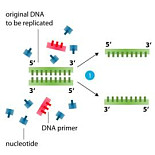
如何利用Primer5.0 设计简并引物
互联网
- 相关专题
- 一步步教你设计简并引物
简并引物设计 都要注意些什么呢?用Primer5.0怎样设计兼并引物呢?下面是网上找到的详细的简并引物设计原则和Primer5.0 设计简并引物的方法可以参考下:
理论上说:由氨基酸回导核酸序列,同时考虑到细菌使用密码子的偏爱性,以减少兼并度,但是这样得到的兼并引物的兼并密码子比较多,我建议你可以先从网上找到已经报道的比较近的几种菌的序列,然后比对,设计兼并引物,这样做没问题,我觉得还比较简便,因为我就是这么做的,也没用primer软件 啊!
另外3端最好不是简并密码子,你可以在网上查查看。
下面是网上找到的详细的简并引物设计 原则和Primer5.0 设计简并引物的方法可以参考下:
简并引物设计 原则:
1. 选择高度保守的序列作为引物。如果可能的话,选择在基因家族内和不同种属间都保守的序列。
2. 选择兼并度最小的序列
a. 含有色氨酸和甲硫氨酸的肽段为首选,因为其密码子是唯一的
b. 尽可能不用含有亮氨酸、精氨酸、丝氨酸的肽段。
3. 若引物序列高度简并,利用脊椎动物基因组 中CpG二核苷酸的较低丰度,可望降低兼并度。并结合密码子优先表,或在有兼并度的地方引入次黄苷来降低兼并度。
4. 引物的3‘端残基尽可能使用确定残基。但令人吃惊的是,当G、C或T发生错配时,3’端的T残基相对保持中立。
5. PCR产物的合适长度为200~1000bp。
6. 如果蛋白中有两个以上的区域高度保守,可构建几套PCR引物,以便使用“巢式”PCR来增加特异性。
PCR反应条件
1. 退火温度 总的来说,退火温度越低,非特异性扩增的可能性越大。低至37度的退火温度也可被采用于高度简并的引物进行PCR扩增。Touchdown PCR也可以减少错误扩增
2. 扩增的循环数 过多循环数导致非特异性带的产生;可以每5个循环取一定样品来检测扩增的特异性
3. 降温时间 不同的PCR仪效率不同。较长的降温时间有利于错配杂交的产生
4. PCR缓冲液成分 主要在于Mg++离子的浓度。
Primer5.0 设计简并引物的方法:
首先把各个CDs序列分别存储为fasta格式,然后在 file-open-DNA sequence 里边把各个序列依次加入,然后点击align,比对完之后再点击primer,调整参数进行search或手工拉动选择引物。表现的形式是非简并性的,但是你从下边可以看得出来哪个碱基是非简并性的,再手工调整。其他原则同一般的简并引物设计原则,如3‘避免简并性等等。
还可以在线用codehop设计,如果需要这种方法,我可以告诉你怎么搞。