碱性磷酸单酯酶的提取和离子交换层析
互联网
碱性磷酸单酯酶的提取和离子交换层析
[原理]
碱性磷酸单酯酶(Alkaline phophatase,简称AKP)为金属酶,在磷酸盐代谢中起重要作用。它能水解磷酸单酯键,但不水解磷酸二酯键,作用于多种底物的酯解,如单核苷酸、葡萄糖-1-磷酸、β-甘油磷酸等。核酸序列分析、DNA重组技术、酶标免疫检测技术都要利用此酶。
AKP是一种多聚体金属酶,酶分子中含有Zn 2+ ,对于酶的活性是必需的。Mg 2+ 、Mn 2+ 、Zn 2+ 等金属离子对酶有激活作用。EDTA等金属螯合物对酶起抑制作用。碱性磷酸单酯酶主要存在于小肠粘膜、肾、骨骼、肝等组织的细胞膜上,其分子量在10~20万之间(随材料来源不同),最适pH8.6~10。碱性磷酸单酯酶工业上可通过微 生物 发酵大量制备,也可从鸡、牛、猪等 生物 材料中提取而得。
本实验取材于猪肾,实验中由正丁醇抽提制备AKP粗制品。
AKP粗制品经离子交换纤维素柱层析来提高其纯度。本实验使用DE-32,它是一种微颗粒纤维素。纤维素糖链之间通过氢键连接成微晶区,同时有少量氢键形成无定形区,将纤维素经过化学处理除去未定形部分,同时又以表氯醇为交联剂,制成微颗粒纤维素。这类纤维素具有结构紧密、电荷密度大、交换容量大等优点。
干燥DEAE-纤维素的溶胀体积随母体种类、交换容量、pH、离子强度等条件而变动。当溶液离子强度为0.01、pH为0.6~7.0时,DE-32的溶胀体积为每克6. 0 ~6.3毫升。DE-32的交换容量为1.0±0.1毫克当量/克(干交换剂)。
AKP在碱性条件下具有较高活性的酶。该类酶对底物的特异性较低,在实验室条件下,各种各样的磷酸单酯,如磷酸苯二钠、对-硝基苯磷酸二钠等多种物质都能被水解为磷酸及各种羟基化合物,酶的活性可以通过测定其分解产物中游离磷酸或羟基化合物在单位时间内的生成量而得出。
本实验采用人工合成的对-硝基苯磷酸二钠(NPP)为底物的方法。对-硝基苯磷酸二钠是无色或稍带黄色的结晶固体,经碱性磷酸单酯酶作用,被水解为游离磷酸及对-硝基苯酚。对-硝基苯酚在强碱条件下呈现醌式结构而显示亮黄色,在405nm处有强烈的吸收峰,而底物没有这种特性。
[方法和步骤]
一、AKP粗制品的制备——从猪肾中制备AKP粗品
(1)除去肾的脂肪,在水中彻底洗净,用滤纸轻轻吸干后,称重。
(2)将组织切成小块,于水中匀浆成约1g/mL 的悬液。
(3)上述匀浆液于15 min内分多次小心加入少量正丁醇(总量为悬液体积的1.5倍),以避免局部过热,继续匀浆。
(4)上述悬液转入 离心管 中,3 000 r/min离心40 min。
(5)用一根细吸管穿过中间层吸出水相酶液,量出体积并取样测定酶活力和蛋白浓度。AKP粗酶液,0℃放置待用(可供柱层析纯化)。
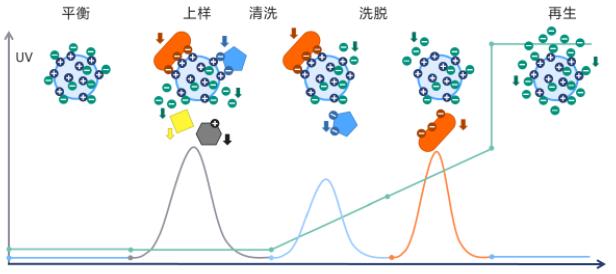
二、离子交换层析纯化碱性磷酸单酯酶
1、DEAE-纤维素的预处理:
(1)称取5gDE-32,撒在盛有75mL 0.5mol/L HCl的烧杯中,室温放置30min,不时轻轻搅拌。
(2)将糊状物移入3号砂芯漏斗中,用蒸馏水淋洗。如此重复,每加一次去离子水,浸泡一段时间,再进行抽滤,至洗涤液pH等于4即可(pH试纸试)。
(3)将糊状物移入烧杯中,加入75mL 0.5mol/L NaOH,放置30min,不时轻轻搅拌,弃去上清液,依同法用0.5mol/L NaOH再处理一次。
(4)将交换剂移入3号砂芯漏斗中,反复用去离子水淋洗,直至洗涤液pH为8.0(可用pH试纸测试)。
(5)将DEAE-纤维素浸泡在150mL去离子水中。用0.5mol/L 盐酸把pH调至7.6,滴定可在pH计上进行,须使悬液最终pH在10min内无变化,然后抽滤。
(6)将上述滤块置于100毫升量筒中,加入75mL缓冲液I,慢慢搅混之后,静置20min,用倾斜法除去上清液中细微粒子,如此重复若干次,最后上清液pH与缓冲液I几乎一致。
2、装柱
(1)层析柱用洗涤液洗清洁,柱的下端联接塑料管,装上螺旋夹。关上螺旋夹,柱内装入缓冲液I,微开螺旋夹。让缓冲液缓慢流出,赶走死区及塑料管中的气泡,柱中保留少量缓冲液,关闭螺旋夹。
(2)将基本平衡好的DEAE-纤维素浆液(约有1倍体积的缓冲液I)放在抽滤瓶中减压除尽气泡,然后沿管壁倒人柱中,待沉降至床高约1cm高度时,部分旋松螺旋夹,让溶液缓慢流出去,注意此时的流速要比正常洗脱时的流速慢,陆续加入较多的浆液,直至达到高10cm以上的柱床体积。
3、平衡
当全部交换剂装入柱中后,用上柱起始缓冲液进行平衡。流速可维持在4mL/15min,直至流出液的pH与上柱缓冲液完全相同。(一般要平衡8h以上或过夜。)
4、层析
用毛细吸管小心吸去交换剂上面大部分液体,打开出口使缓冲液Ⅰ恰流到表面,关闭出口。用毛细吸管小心地沿柱壁四周缓缓加入AKP粗酶液,打开出口,使样品溶液进入纤维素内,至几乎露出床面时,柱壁用少量缓冲液小心洗涤2~3次,然后装入缓冲液Ⅰ,使液面高出创面2~3 cm左右。
5、洗脱
(1)按图将梯度洗脱器和层析柱连接好。
(2)在洗脱瓶A(贮存器)和洗脱瓶B(混合器)内各装入100mL缓冲液Ⅰ和缓冲液Ⅱ,注意两洗脱瓶,特别是液面应处于同一水平面,同时应排除连接管内气泡。
(3)开动电磁搅拌器开关,调节搅拌速度,以混合器内缓冲液旋转而无明显旋涡为宜。
(4)将两瓶和柱上下连接管道打开,开始收集洗脱流出液,控制流速在5mL /10min,每管收集5mL。
三、AKP酶活性的测定
以对硝基酚磷酸二钠为底物,根据水解磷酯键所产生的对硝基酚量测定酶活力。在37℃、pH10条件下,每分钟转化产生1μmol/L对硝基酚的酶量为1个酶单位。
具体测定步骤如下:
取0.5mL 0.02mol/L对硝基苯磷酸二钠, 1.5mL底物缓冲液, 于 试管 中混合后, 在37℃预热5min,再加入0.5mL酶液,立即混匀,记时,37℃保温20min,立即加入1mL 0.5mol/L NaOH停止酶反应,然后于405nm处测吸收值,空白对照先加入NaOH后再加酶液。
四、酶液蛋白质浓度测定(可参照实验七~十)
[结果与计算]
1、计算AKP粗酶液中酶活性、蛋白质浓度和酶的比活力。
已知对硝基酚的摩尔消化系数ε:ε 405 1cm =18.8 × 10 3 ,可按下列公式求出每毫升酶活力单位数。
2、离子交换层析中每个收集管进行酶活的定性测定,有酶活的收集管进行酶活的定量测定。合并有酶活的各收集管,计量总体积,并进行酶活的定量测定。
3、测每个收集管中溶液的A 280 值。
4、画出层析图谱并标出酶活曲线和线性梯度曲线。
5、计算蛋白回收率、酶活回收率、纯化倍数。
6、求出酶活最高峰时洗脱液盐的浓度。
[附]
1、酶活的定性测定
取白瓷板一块,每个孔穴内加入一滴底物溶液,3滴底物 缓冲液 ,一滴洗脱液,定性检测酶活性在各收集管中的分布。
2、洗脱液盐浓度计算方法
对于线性梯度洗脱,在一定时间内洗脱混合器NaC1浓度C和从层析柱流出溶液的体积V的关系可用下式表示:
式中 Ca、C b ——分别表示梯度洗脱仪贮液器和混合器中起始NaCl溶液的浓度;
V——梯度洗脱液的总体积;
V——洗脱液体积。
将已知V、v代入公式,即可计算得到对应流过柱洗脱液体积v时的混合器内洗脱液盐浓度C。