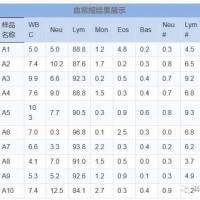
流式细胞术常规检测时的样品制备
互联网
一、流式细胞术常规检测时的样品制备
( 一 ) 直接免疫荧光标记法
取一定量细胞 ( 约 1X106 细胞/ ml) ,在每一管中分别加入 50 μ l 的 HAB ,并充分混匀,于室温中静置 1 分钟以上 (), 再直接加入连接有荧光素的抗体进行免疫标记反应 ( 如做双标或多标染色,可把几种标记有不同荧光素的抗体同时加入 ) ,。孵育 20-60 分钟后,用 PBS(pH7 . 2 ― 7 . 4) 洗 1-2 次,加入缓冲液重悬,上机检测。本方法操作简便,结果准确,易于分析,适用于同一细胞群多参数同时测定。虽然直标抗体试剂成本较高,但减少了间接标记法中较强的非特异荧光的干扰,因此更适用于临床标本的检测。
( 二 ) 间接免疫荧光标记法
取一定量的细胞悬液 ( 约 1X106 细胞/ ml) ,先加入特异的第一抗体,待反应完全后洗去未结合抗体,再加入荧光标记的第二抗体,生成抗原―抗体―抗抗体复合物,以 FCM 检测其上标记的荧光素被激发后发出的荧光。本方法费用较低,二抗应用广泛,多用于科研标本的检测。但由于二抗一般为多克隆抗体,特异性较差,非特异性荧光背景较强,易影响实验结果。所以标本制备时应加入阴性或阳性对照。另外,由于间标法步骤较多,增加了细胞的丢失,不适用测定细胞数较少的标本。
二、最小化非特异性结合的方法
1 .荧光标记的抗体的浓度应该合适,如果浓度过高,背景会因为非特异性的相互作用的增加而增加。
2 .在使用第一抗体之前,将样品与过量的蛋白一起培育,如小牛血清蛋白( BSA ),脱脂干奶酪,或来自于同一寄主的正常血清来作为标记的第二抗体。这个步骤通过阻断第一抗体和细胞表面或胞内结构的非特异性的交互作用来降低背景。
3 .在使用第一抗体之后,将样品与 5% 至 10% 的来自于同一寄主的正常血清和作为标记的第二抗体一起培育。这个步骤会减少不必要的第二抗体与第一抗体、细胞表面或胞内结构之间的交互作用。
通过用来自于同样的样品的血清稀释标记过的抗体可以略过此步骤。此步骤适用于很多方面,但有时候它也会导致已标记的第二抗体和正常血清中的免疫球蛋白的免疫复合体的形成。这种复合体会优先与一些细胞结构进行结合,或者它们最终会导致期望得到的抗体活性的丢失。
4 .使用 F(ab ’ )2 片段会使背景决定于第一或第二抗体与 FC 受体的全分子结合。大多数的第二抗体的 F(ab ’ )2 片段容易利用。而第一抗体的 F(ab ’ )2 片段一般是不能利用或很难制作。因此,在 NaN3 存在的条件下,将新鲜组织或细胞与正常血清一起培育应选择优先加入第一抗体。在此情况下,即使在随后的步骤中用完所有的抗体分子, FC 受体决定的背景影响已不再重要。
5 .其它:已标记的抗体和其他一些内在的免疫球蛋白或加入实验系统中的其它物质的交叉反应也可能会有背景影响。为了降低背景,在多重标记过程中,所有的已标记的抗体应被吸附,避免其他种类蛋白的交叉反应。