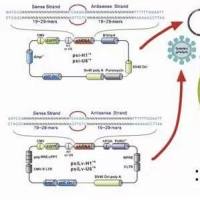
重组质粒的转化、筛选和鉴定操作
互联网
摘要: 学习克隆工作中最常用的双酶切,将外源基因与质粒连接方法及操作技术.
一、实验目的:
1、学习克隆工作中最常用的双酶切;
2、学习将外源基因与质粒连接方法及操作技术;
3、学习氯化钙法制备 大肠杆菌 感受态细胞的技术;
4、了解细胞转化的概念及其在分子生物学研究中的意义.
5、外源质粒 DNA 转入受体菌细胞的技术以及筛选转化体的技术.
6、学习鉴定重组子的方法.
二、实验原理:
重组子的建立:采用双酶切 质粒 载体pBR322和pUC18,酶切后产生了互补的粘性末端,在T4 DNA 连接酶的作用下,两个质粒片段连接.
感受态细胞(Competent cells):受体细胞经过一些特殊方法(如:CaCl,RuCl等化学试剂法)的处理后, 细胞膜 的通透性发生变化,成为能容许多有外源DNA的载体分子通过的感受态细胞(competent cell) .
转化(transformation):是将异源DNA分子引入一 细胞株 系,使受体细胞获得新的遗传性状的一种手段,是基因工程等研究领域的基本实验技术.
电转化法:使用低盐缓冲液或水洗制备的感受态细胞,通过高压脉冲的作用将载体DNA分子导入受体细胞.
克隆的筛选:主要用不同 抗生素 基因筛选.常用的 抗生素 有:氨苄青霉素、卡那霉素、氯霉素、四环素、链霉素等;
重组质粒克隆的鉴定:鉴定带有重组质粒克隆的方法常用的有α-互补、小规模制备质粒DNA进行酶切分析、插入失活、PCR以及杂交筛选的方法.
最常用的方法是小规模制备质粒DNA进行酶切分析,对于带有LacZ基因的载体还可以结合α-互补现象来筛选.
三、试剂与器材:
1、试剂:pUC18质粒,pBR322质粒,DL2000 Marker, Pst I(15U/ul)及酶切缓冲液, EcoR I(15U/ul)及酶切缓冲液,DNA Ligation Kit Ver 2.1 (TaKaRa),LB液体培养基(Luria-Bertani) ,LB固体培养基,50mg/ml卡那霉素(kanamycin)储存液,质粒快速提取试剂盒(博大泰克),10 X Buffer K, Pst I,EcoR I (TaKaRa)
2、器材:电基因转移议,恒温摇床,台式高速离心机,恒温水浴锅, 琼脂糖凝胶电泳装置,电热恒温
培养箱
,电泳仪,超净工作台, 微量移液枪,eppendorf管.
四、操作方法:
1、构建重组质粒
质粒pUC18和pBR322分别用Pst I和EcoR I双酶切,将酶切产物按照1:1的比例混合,使用T4 DNA连接酶连接,构建成重组质粒.
2、制备感受态大肠杆菌细胞
收集大肠杆菌细胞,采用CaCl2处理,制备成 感受态细胞 .
3、重组子的转化
将构建的重组质粒加入到制备的感受态细胞悬浮液中,电击法将重组质粒转化到宿主细胞中.
4、重组子的筛选鉴定
采用蓝白筛选重组子.酚/氯仿快速抽提质粒,酶切后
电泳
鉴定.
五、关键步骤与注意事项:
1、连接反应温度选择要适中,过高粘末端之间形成氢键不稳定,过低会影响 连接酶 的活性.
2、连接反应两种质粒的比例为1:1,否则容易自连.
3、制备感受态细胞时要采用对数生长期初期的细胞,低温处理时间要足够.
4、电击法时电击电压、电流、时间选择要合适.
5、转化及蓝白筛选要作阴、阳性对照,防止出现假阳性、假阴性.
六、思考题:
1、连接反应的温度选择的依据是什么?
2、试分析自己实验得到的电泳结果?
3、怎样保证DNA片段的高回收率和连接的高效率?
4、制备感受态细胞的原理是什么?
5、可将外源基因转化受体细胞的方法有哪些?
6、通过什么手段可以降低质粒自身环化的数量?