血清丙氨酸氨基转移酶(ALT)活性测定
互联网
【实验目的】
1.掌握血清丙氨酸氨基转移酶活性测定的基本原理。
2.了解血清丙氨酸氨基转移酶的测定方法及临床意义。
【 实验原理 】
丙氨酸氨基转移酶(ALT)催化丙氨酸与α—酮戊二酸生成丙酮酸和谷氨酸。 丙酮酸产量的多少,即反应酶活性的大小。
丙酮酸可与2,4—二硝基苯肼在酸性溶液中反应形成相应的2,4-二硝基苯腙,呈黄色,后者在碱性条件下呈红棕色。通过测定其在520nm波长处的光吸收来了解丙酮酸的生成量,借此测定血清ALT的活力,故该类方法又称比色测定法。该法虽然也有缺点,但操作简便,不需要特殊 仪器 和 试剂 ,故在临床上被广泛应用。
/> /> />
该法的单位定义是:每lml血清在pH7.4, 37℃/>保温条件下与底物作用30分钟,每生成2.5μg丙酮酸为一个单位。人血清的丙氨酸氨基转移酶正常值为2~40U。
【 器材和试剂 】
1.器材 恒温水浴、721、722分光光度计、液体混合器、刻度吸量管、滴管、 试管 等
2.试剂
(1) 0.1mol/L 磷酸盐缓冲液(pH 7.4):称取无水磷酸二氢钾(KH 2 PO 4 ) 2.69克/>和磷酸氢二钾K 2 HPO 4 · 3H 2 O 13.97g/>加蒸馏水溶解后移至1 000ml容量瓶中,校正pH到7.4,然后加蒸馏水至刻度。贮存于冰箱中备用。
(2)丙氨酸氨基转移酶底物液(pH7.4):精确称取DL-丙氨酸 1.78g/>和α—酮戊二酸 29.2g/>,先溶于0.1mol/L 磷酸盐缓冲液约50ml中,然后用1mol/L NaOH 校正pH到7.4,再用磷酸缓冲液稀释到 100ml。充分混匀,冰箱保存,可保存一周。
(3)0.02% 2,4-二硝基苯肼溶液( 1mM/>):精确称取2,4-二硝基苯肼20mg溶于1mo1/L盐酸中,待溶解后用1mo1/L盐酸稀释至100ml过滤后使用。
(4) 0.4M/>/L氢氧化钠溶液。
(5)丙酮酸标准液(500μg/ml):精确称取丙酮酸钠62.5mg溶于0.1mol/LH 2 SO 4 100ml中, 此试剂需现用现配。
【 操作步骤 】
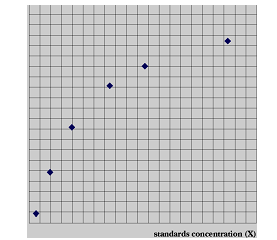
1.标准曲线的制作 取干燥洁净 试管 9支,编号,按下表加入试剂,混匀:
另取干燥洁净试管11支,编号,在1~9号试管中依次加入上述稀释的1~9号丙酮酸标准液0.1ml,在10号管中加入未经稀释的丙酮酸标准液(500μg/ml) 0.1ml,再按下表操作。
各管混匀,于室温静置10分钟,520nm波长,以第11管为空白管比色,读取各管光密度将各管丙酮酸含量(5-50μg)按下式换算成谷丙转氨酶活力单位:
以每100ml血清中丙氨酸氨基转移酶活力单位为横坐标,光密度为纵坐标绘制标准曲线。
2.酶活性的测定 取干燥洁净试管2支,标明测定管和对照管,按下表操作。
混匀,静置10min,用分光光度计,在520nm波长,用 蒸馏 水调节零点,读取测定管和对照管光密度,以测定管光密度值减去对照管光密度值,然后从标准曲线上查出其酶的活力单位。
【 注意事项 】
1.标本应空腹取血,当时进行测定或将分离的血清贮存于冰箱中。
2.酶的测定结果与酶作用时间、温度、PH及试剂加入量等有关,在操作时均应准确掌握。
3.测定试剂更换时,要重新制作标准曲线。
【 临床意义 】
ALT广泛存在于一般组织细胞中,肝细胞中此酶含量最多。肝炎、中毒性肝细胞坏死等肝病时,血清中此酶活性增加,其他疾病如心肌梗塞、心肌炎等亦有增高。故血清丙氨酸氨基转移谷丙转氨酶活性得测定在临床诊断上具有重要意义。
【 附注 】
1 . 酶活力的意义及测定方法 研究酶促反应速度和各种因素对酶促反应速度的影响时,一般以酶的活力单位为观察指标。酶活力是指酶催化化学反应的能力;酶活力的大小用酶活力单位表示,酶的一个国际单位为在 25℃/>下,1分钟内催化1μmol/L底物的酶量,或是转化1微摩尔(1μmol)底物的有关基团的酶量。测定酶活力时,常常用产物的生成量或是底物的消耗量来计算。一般以测定产物增加量为好,因为产物从无到有,只要方法足够灵敏就可以准确测定。
2.测定血清丙氨酸氨基转移酶活性的方法简介 一类是分光光度法,另一类是比色法。前者是测定酶速率的方法,需要紫外 分光光度计 与酶试剂。后者有金式(King)法,穆氏(Mohum)法与赖氏(Reitman Frankel)法3种。
这3种方法是目前国内测定ALT的主要方法,他们的测定原理、试剂和操作步骤及采用温度等方面均完全相同,主要不同点为酶与底物的作用时间、标准曲线绘制方法和单位定义。在作用时间上,金氏为60min,其余两法均为30min。金氏法的单位是:100ml血清与足量丙氨酸、α-酮戊二酸在pH7.4 37℃/>保温1h,每生成1μmol丙酮酸,称为一个丙氨酸氨基 转移酶 活力单位。穆氏法的单位定义是:每毫升血清在pH7.4, 37℃/>保温条件下与底物作用30min,每生成2.5μg丙酮酸为一个单位。赖氏法的单位定义是:血清1ml,反应总液量3 ml,在 25℃/>、340nm光波下,光径 1cm/>,1 min使光密度降低0.001为一个单位。由于不同方法测得丙氨酸氨基 转移酶 的活力单位正常值范围不同,故临床评价其诊断意义时,必须首先明确是什么活力单位及该法正常值,而后才能对检验结果作出准确结论。
【思考题】
1、ALT的临床意义?
2、ALT的正常值是多少7
3、对照管的意义是什么?
4、底物液为何要 37℃/>预温5min?




![聚[1,4-双(羟乙基)对苯二甲酸酯-alt-乙氧基磷酸酯]-co-1,4-双(羟乙基)对苯二甲酸酯-co-对苯二甲酸酯,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/683/4266052164917523081.jpg!wh200)