分子信标的原理、应用及其研究进展
互联网
摘要 分子信标技术是一种基于荧光共振能量转移现象(FRET)和碱基互补配对原则建立起来的一种分析技术。分子信标作为一种荧光标记的分子探针,具有极强的特异性和较高的灵敏度,目前已经成为基础医学和生物学的重要研究工具。本文着重介绍了分子信标的基本原理及其应用,并对其近年来的研究进展做以简单介绍。
1 引言
在基因时代和蛋白质时代,人们迫切需要一种具有高灵敏度和高亲和力的生物分子探针,用以进行定性和定量检测。1996年Tyagi和Kramer首先建立了分子信标技术,很快这种技术就广泛的应用于医学、生物学、分子生物学、临床医学和化学等诸多领域。
分子信标技术具有极高的特异性,而且操作简便、灵敏度高,特别是它可以进行实时定量检测、甚至可以用于活体分析。在临床诊断、基因检测等领域,分子信标也越来越显示出它的优势。近年来,人们对分子信标的结构作了诸多改进,发展出很多具有更多特性的新型分子信标。随着分子信标的发展,该技术也必将在更多领域中发挥出它的优势。
2 分子信标的原理
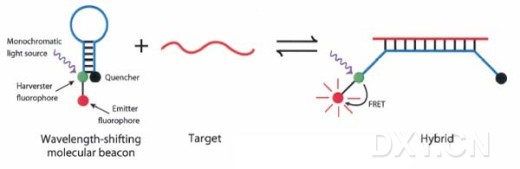
分子信标是一种荧光标记的寡核苷酸链,一般含有25~35个核苷酸。在结构上,分子信标大体上可以分为三部分:
(1)、环状区:一般由15~30个核苷酸组成,可以与靶分子特异结合;
(2)、茎干区:一般由5~8个碱基对组成,在分子信标与靶分子结合过程中可发生可逆性解离。
(3)、荧光基团和淬灭基团:荧光基团一般连接在5ˊ端;淬灭基团一般连接在3ˊ端,常用4-(4-二甲基氨基偶氮苯基)苯甲酸(DABCYL)作为淬灭基团。根据Foerster理论,中心荧光能量转移效率与两者距离的6次方成反比。所以只有荧光基团与淬灭基团之间达到一定的距离时才会产生荧光。
自由状态时,分子信标呈发卡式结构,从而荧光基团和淬灭基团相距较近(约7~10nm)。此时发生荧光共振能量转移,使荧光基团发出的荧光被淬灭基团吸收并以热的形式散发,荧光几乎完全被淬灭,荧光本底极低。当分子信标与靶分子结合时,荧光基团和淬灭基团之间的距离加大,从而,分子信标的荧光几乎100%恢复。而且所检测到的荧光强度与溶液中靶标量成正比。
3 影响分子信标的主要因素
分子信标中,荧光基团和淬灭基团之间的距离是影响分子信标的最主要因素。根据Foerster理论,荧光基团与淬灭基团之间的距离直接影响荧光的强度。
另外,温度也是影响分子信标的一个重要因素。在较低温度下,分子信标才可以保持发卡结构。在较高温度下,分子信标将无法保持其发卡结构,甚至使其伸展为随机线状,造成荧光基团和淬灭基团分离,从而发出荧光,出现假阳性结果。有文献表明,其熔链温度取决于茎干区的长度、G-C含量和缓冲液的离子强度。
Bonnet等研究温度对分子信标影响时发现,体系的荧光强度呈现为一个先减弱后增强的过程。就此,Bonnet等做出如下解释:
在较低温度下,分子信标与靶标结合呈S1状态,发出荧光。随着温度升高,分子信标与靶标分离,分子信标重新恢复为发卡式结构即S2状态,从而荧光强度减弱。温度持续增高,将导致分子信标熔链即S3状态,荧光基团与淬灭基团分离,导致荧光恢复。
环境pH值也是影响分子信标的一个因素。pH值过高,分子信标的发卡结构可能被破坏,出现假阳性结果。此外,分子信标的纯度,也将对分子信标产生影响。
4、分子信标技术在基础医学中的应用
分子信标技术最初被用作PCR的荧光探针,它既可以对扩增产物进行定量检测,又可以对扩增过程进行实时的检测。近年来,随着分子信标技术的发展和成熟,人们不断开拓其应用领域,目前,分子信标不仅可以用于基因的定量、定性检测,还可以用于基因点突变等的分析,将分子信标与PNA-DNA-环技术结合,使检测双链DNA成为可能。另外,分子信标技术还为研究DNA-蛋白质之间的相互作用提供了一种简单、直接、灵敏、实时、甚至可以用于活体检测的方法。利用分子信标技术在分析、检测核酸和蛋白质中的优点,分子信标技术还可以作为生物芯片和生物传感器的探针。总之,分子信标技术已经广泛的应用在基础医学研究中的众多领域。
4.1 实时定量PCR测定靶标浓度
分子信标技术在其出现之初就被用于实时定量PCR测定靶标浓度。这一技术是基于荧光信号积累实时检测整个PCR进程。它是在常规的PCR的基础上加入相应的分子信标,在PCR的每一循环过程中,都会发生分子信标与扩增产物结合,从而产生荧光,但这并不影响PCR的整个过程。并且只有能和分子信标结合的DNA模板得到扩增时才能产生荧光信号。所以荧光强度与特异性扩增产物的量成正比,它是模板被PCR扩增的直接标志。与常规的核酸检测方法相比,分子信标可以进行闭管操作,有效消除核酸的交叉污染,具有实时、定量、高灵敏度、高特异性等特点。
4.2 用于活体内核酸的动态检测
通过将分子信标注入活细胞内,使分子信标与特定的模板结合产生荧光。可以通过荧光显微镜实时、动态的检测整个过程。如可以用于细胞内mRNA的动态检测,以了解其在转录等过程中的变化。但活体内存在大量的酶,其中某些酶可能导致分子信标水解,使其结构破坏产生荧光,出现假阳性结果。PNA分子信标可以很好的解决这一问题,PNA分子信标可以有效的避免核酶的水解,使荧光强度能准确反映活体内的过程。
4.3 用于双链DNA的检测
与RNA不同,DNA是双螺旋结构,常规方法难以进行检测。而分子信标技术可用于双链DNA分子的检测。PNA与双链DNA互补链结合时可以取代非互补链,使其解离成单链,形成P环结构。解离后的DNA双链及可用分子信标技术检测,使分子信标与DNA变性部分结合,从而出现荧光。
4.4 用于蛋白质的检测
随着基因组学的发展,出现了蛋白质组学,人们越来越发现许多问题要到蛋白质中去寻找答案。这就要求人们能够对蛋白质各方面的性质可以加以检测。此外,人们把蛋白质和核酸联系起来,研究蛋白质和核酸之间的相互作用,这一课题已成为现代分子生物学的研究热点之一。与传统的蛋白质研究方法(如X单晶衍射、圆二色谱等技术)相比,分子信标技术具有简单、灵敏的特点,又可以实现实时检测,甚至可以用于活体检测。
2001年,Tan等发表文章阐述了其应用分子信标技术研究蛋白质所取得的结果。他们用分子信标来检测单链结合蛋白,实验发现,分子信标产生的荧光。所产生的荧光强度较分子信标与核酸结合时产生的荧光强度小,但其强度远远大于分子信标与核酸发生错配时产生的荧光强度。同时他们还发现分子信标不能与双链结合蛋白结合,产生荧光。
Nobuko Hamaguchi根据分子信标的原理设计了Aptamer信标,可以直接用来检测蛋白质。这一方法与传统的酶联免疫吸附法测定蛋白质相比,具有简单、灵敏等优点。但这一方法不能用于检测非特异性ssDNA结合蛋白,而且分子信标的构象受金属离子影响很大,一些金属离子的存在会干扰荧光信号的观测。
4.5 用于基因的检测
在基因时代,基因的检测方法也取得了飞速发展。近年来,国内外很多科学家尝试用分子信标技术来检测基因,并取得了初步的成果。人们将分子信标技术与毛细管电泳技术相结合,初步实现了基因检测的自动化或半自动化,使大面积、高通量筛选成为可能。
5、分子信标技术在临床医学中的应用
5.1 分子信标技术在癌症诊断中的应用
2001年宾夕法尼亚大学的B.Chance 教授在美国物理学会上宣布,他和同事合作制得了可以用于癌症诊断的分子信标,并在老鼠体内取得了初步的成功,已准备做临床实验。
他们首先将分子信标注射到体内,当它与乳腺癌有关的生化酶发生作用时才会打开,否则就保持密封状态。信标打开后就会在体外装置中的光束在近红外处发生荧光响应,从而探测到信标的信号,由于信标能发射大量的近红外光,所以它可以通过人体。这种方法没有离子辐射且价格便宜,其成本约为几千美元。这种装置的另一个优点是它的工艺及实施以常用的光盘和单元电话为基础的,从而简便、易行。
5.2 分子信标技术用于SARS的诊断
2003年SARS病毒在中国内地的出现以及在全球部分国家的肆意和传播,给人类健康提出了严峻的挑战。许多国家的科研人员都在开发快速和精确检测SARS病毒的方法和技术,诸如RT-PCR、ELISA、免疫荧光法等,并已经在推出相应的检测试剂盒。但是,目前这些检测仍然需要结合临床体征的判断,这主要是由于这几种方法还存在着一些自身缺陷,比如RT-PCR对SARS检测的灵敏性还不令人满意,即有出现假阴性的倾向,曾报道有出现漏检的情况发生;使用免疫荧光法和ELISA法的SARS抗体检测也存在敏感性问题;其中免疫荧光法又只能在病人感染病毒10天以后才能检测出抗体,而ELISA则要在20天以后才能检测出抗体。
分子信标技术的基本原理应用的是碱基互补配对原则,这就有效的保证了用此技术检测SARS病毒的特异性。此外作为基因水平的检测其灵敏性也较上述方法高。于上述方法需要再感染几天后才能检出相比,分子信标技术只要体内有SARS病毒的核酸出现即可被检出,从而为临床治疗赢得宝贵的时间,具有较大的临床应用价值。
5.3 分子信标技术用于乙肝病毒的检测
Yates等2001年在临床微生物学杂志发表文章,提出了用分子信标技术检测乙肝病毒的方法。该方法定量检测HBV DNA,具有简便、易行、可靠等优点,有很好的应用前景。目前,国外已有成型的试剂盒出售,国内也有类似产品。
6 前景与展望
分子信标技术自其诞生以来,由于它极高的特异性、灵敏度等特点迅速进入生物学、基础医学、临床医学等各个相关领域。人们对分子信标的结构也进行了数次改进和发展,使之可以在更广的范围内发挥更大的作用。以分子信标技术为基础人们开发出可进行高通量筛选的芯片。如果该技术与纳米技术、激光共聚焦技术等其他先进技术相结合,也必然会促进分子信标技术的发展。毫无疑问的是分子信标技术有着广阔的应用空间。随着制备技术的发展,设计方法的改进分子信标技术必将更加完善。
参考文献
[1] S Tyagi, F R Kramer Nat Biotechnol, 1996,14: 303~308
[2] Ota N, Hirano K, Warashina M, et al, Nucleic Acids Res, 1998, 26(3): 735~743
[3] Sokol D, Zhang X L, Lu P et al, Proc Natl.Acid Sci.US, 1998, 95: 11538~11543
[4] Bukanov N O, Denidov V V, Nielsen P E et al, Proc Natl.Acid Sci.US, 1998, 95: 5516~5520
[5] Yates S, Penning M, Goudsmit J, et al, J Clin Microbiol, 2001, 39:3656~3665
[6] 周海清 沈鹤柏等 光谱实验室 2004,V21 417~422
[7] 陈忠斌 王升启 孙志贤 生物化学与生物物理学进展 1998,25 488~492
[8] 王怡瑾 王宏等 化学通报 2004 12 912~918
[9] 姜晓峰 王雅杰 张琨 中国实验诊断学 2003 7(3)185~189