最近做原核表达的几点教训和体会
互联网
最近在做原核表达,包涵体。以前也做过,但经验不多。从园子里也学到不少。一点失败的教训以及纯化过程中的体会,贴出来与大家共享,同时希望得到同行们的指正。
1. 首先介绍一下背景。载体是novagen公司的pET22b,Amp抗性。菌株是Invitrogen的BL21 star DE3,是一个蛋白降解酶突变菌株,也就是说是一种优化表达菌株。
2. 第一次失败。第一次做诱导的时候,重复了很多次,但总是诱导不出来。PCR,酶切都正确。但没等测序结果出来就开始做了。失败了。曾在园子求助。后来证明是引物错误。我们实验室合成引物都要先发给purchasing office,然后才由他们与公司交涉。这个office的老太太把引物弄掉了一个碱基。
教训:在实验过程中,再仔细都是不为过的。引物来了后管壁上贴有序列,但我忽略了。
3. 第二次失败。后来重新构建,转化,诱导。第一次诱导时根本就没带。见附图(图片质量太差了,sorry,下面几个帖会逐渐好转。我们都在失败中提高,进步,不是吗)。
然后开始找闷头原因。周一下午5点我就接了DE3菌,由于那天人非常不舒服,去看医生了,等了很久,到第二天中午11点才转接!而且是按1:50转接的!也就是菌在转接之前培养了18 h!
我们都知道,带Amp的E.coli在含Amp的平板上培养超过16 h后,菌周围会长出小菌落,我们叫它卫星菌落。这是因为细菌在生长的时候,为了抵抗Amp,会分泌B-内酰胺酶,而该酶会降解培养基中的Amp。对Amp产生抗性的机制和其他抗生素的情况是不同的(具体可以翻看分子克隆)。
到菌体生长到足够浓度的时候,培养基的Amp就会慢慢减少。一旦细菌失去选择压力,就可能造成质粒丢失。
当Amp降到很低,不足以抑制细菌生长时,未携带质粒的菌就会长得比带质粒的快。所以当培养时间足够长后,培养基中的B-内酰胺酶就会积累到很高的浓度。转接时(我是1:50转的),高浓度的酶可能破坏新鲜培养基中的Amp(而且我用的浓度是50 ug/ml)。这样,就造成最后收集的菌中,大部分都是没有带质粒的菌了。
当然还有一个可能的原因就是死亡的菌体分泌一些降解酶,使得表达检测失败。
这两种推测都只是推测,但我觉得第一种情况应该引起我们的重视。在使用Amp抗性的时候要格外注意。

4. 第三次做诱导就格外小心了。首先,晚上12点我才接菌,到第二天早上就开始转接了。这次用的是100 ug/ul的Amp浓度。转接的时候是1:500稀释。(我不知道1:100行不行,一朝被蛇咬,十年怕井绳啊。在OD600达到0.8的时候诱导。
转接的时候做对照:IPTG 0 h,
同时做诱导:2 h, 3 h
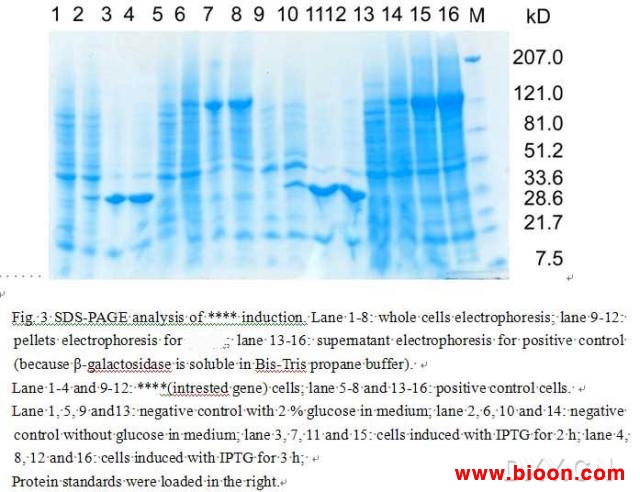
结果见附图。图注的大概意思:
从左到右的泳道依次是:阴性对照,诱导2 h,诱导3 h;由于我做的是包涵体,所以前面点的都是沉淀,16,17点的上清。但这两个泳道太难看了。后面的胶会好一点,sorry。
主要结果有三:
A. 有表达。
B. 阴性对照也有表达,所以这个结果不是很convincing。
C. 目的蛋白应该在30 kD,但分子量显示是36 kD左右(这个问题是个低级错误,接下来的帖子会指出)。
原因分析:
为什么阴性对照会有带?我想起表达毒性蛋白的protocol. 表达毒性蛋白的时候,由于DE3可能根本就不长,或者长得很慢,这时候我们会在培养基中加glucose。当培养基中有其他首选碳源,如glucose时,细菌会优先选择glucose,而glucose会抑制cAMP的活性从而关闭乳糖操纵子。
为什么要加入glucose呢?我们用的DYT或者LB培养基中含有丰富的tryptone。后者可能含有微量的乳糖。所以虽然没有加IPTG,其中的lactose同样可能诱导蛋白的表达。这样毒性蛋白在加IPTG前就开始表达了,杀死或者抑制了细菌的生长。
那么我的这个实验中,阴性对照出现的带是不是也是因为这个原因引起的呢?为了验证,进一步做了实验,

要验证阴性对照中的带是不是由于培养基中的微量lactose的,可以做如下实验:
A. 测培养基中乳糖含量;
B. 购买无乳糖培养基;
但是我不愿浪费时间在这上面。。。卖个关子哈,实际上,我做了如下的一组处理:
a. 阴性对照+2%glucose
b. 阴性对照 without glucose
c. 诱导2 h
d. 诱导3 h
这个处理其实存在设计上的错误。如果要得出严谨的结论,应该要加一个2%glucose的诱导处理。这样,预期的结果就是:
a. 无目的条带,
b. 有目的条带,但不够多,
c. 有
d. 有
e. 2%glucose, 诱导,无目的条带或者仅有很浅的带。
很抱歉,e没有做。那天很久没用的两瓶glucose中的一瓶被污染了。。。
结果见附图。图注的大概意思:
从左到右的泳道都是按a, b, c, d处理排列的。5-8以及13-16泳道是positive expression control。是pET15b携带b-galactosidase的一个构建。泳道1-8是全细胞蛋白电泳;泳道9-12是取沉淀电泳;13-16是上清电泳。
结果:
a. 有glucose的阴性对照无带(或非常浅)。
b. 无glucose的阴性对照有带,但整体来说比诱导的弱。
c. 诱导的有带。
d. 蛋白大小还是不对(其实是对的,我冤枉它了,请看后面的帖子)。
结论:培养基中确实很可能存在lactose。而且应该是造成阴性对照有表达的原因。

现在头疼的就是分子量的问题了。首先,切胶做MS。见附图。那三个洞洞就是偶挖滴。根据公司的报告,这个蛋白就是我们要的蛋白。然后就开始怀疑分子量marker了。细心的战友可能发现了,我下面这个图marker其实跟上面几个图都是一样的,但标的不一样了。这就是我说的低级错误:
我之前的图是按Tris-HCl buffer,12%的胶标的。但我跑的Bis-Tris胶,而且是MES buffer。而marker在这两种buffer(胶)中所代表的分子量是不同的。

apparent MW跟calculated MW有时候是相差很大的。在园子里见过很多战友询问分子量不对的问题,不知道这个是否有用?把我的体会贴到这里,衷心希望与大家一起探讨。欢迎指正!最后祝大家实验顺利!