ELISA实验原理、步骤、ELISA问题分析
互联网
- 相关专题
- ELISA免疫实验技术 免疫试剂实验方法小结
ELISA实验原理
酶联免疫 吸附测定(enzyme linked immunosorbent assay,ELISA)原理
1971年Engvall和Perlmann发表了酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)用于IgG定量测定的文章,使得1966年开始用于抗原 定位的酶标抗体技术发展成液体标本中微量物质的测定方法。
ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。结合在固相载体 表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。
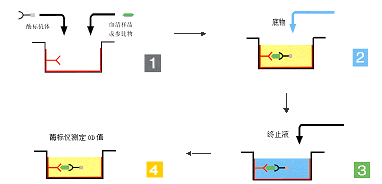
在测定时,受检标本(测定其中的抗体或抗原)与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与液体中的其他物质分开。再加入酶标记的抗原或抗体,也通过反应而结合在固相载体上。
此时固相上的酶量与标本中受检物质的量呈一定的比例。加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。
由于酶的催化频率很高,故可极大地地放大反应效果,从而使测定方法达到很高的敏感度
类型及步骤
ELISA的主要常用类型及步骤
1. 间接法测抗体
间接法是检测抗体常用的方法。其原理为利用酶标记的抗抗体(二抗)以检测与固相抗原 结合的受检抗体,故称为间接法。操作步骤如下:
1)将特异性抗原与固相载体 联结,形成固相抗原,洗涤除去未结合的抗原及杂质。
2)加稀释的样本,保温反应。样本中的特异抗体与固相抗原结合,形成固相抗原抗体复合物。经洗涤后,固相载体上只留下特异性抗体,样本中的其他成份在洗涤过程中被洗去。
3)加酶标抗抗体。固相免疫复合物中的抗体与酶标抗抗体结合,从而间接地标记上酶。洗涤后,固相载体上的酶量与样本中受检抗体的量正相关。
4)加底物显色。
<center> </center>2. 双抗体夹心法测抗原
双抗体夹心法是检测抗原最常用的方法,操作步骤如下:
1)将特异性抗体与固相载体联结,形成固相抗体。洗涤除去未结合的抗体及杂质。
2)加受检样本,保温反应。样本中的抗原与固相抗体结合,形成固相抗原抗体复合物。洗涤除去其他未结合物质。
3)加酶标抗体,保温反应。固相免疫复合物上的抗原与酶标抗体结合。彻底洗涤未结合的酶标抗体。此时固相载体上带有的酶量与样本中受检抗原的量相关。
4)加底物显色。
3. 双抗原夹心法测抗体
反应原理和模式与双抗体夹心法类似。用特异性抗原进行包被和制备酶结合物,以检测相应的抗体。与间接法测抗体的不同之处为以酶标抗原代替酶标抗抗体
<center> </center>4.竞争法测抗原
小分子抗原或半抗原因缺乏可作夹心法的两个以上的位点,因此不能用双抗体夹心法进行测定,可以采用竞争法模式。其原理是标本中的抗原和一定量的酶标抗原竞争与固相抗体结合。标本中抗原量含量愈多,结合在固相上的酶标抗原愈少,最后的显色也愈浅。小分子激素、药物等ELISA测定多用此法。
<center> </center>ELISA Q&A
如何选择合适的阳性对照?
阳性对照的基本组成应该尽量与检测样本的组成一致,一般阳性对照多以含蛋白保护剂的缓冲液为基质,加入一定量的待检物质。比如,以人血清为标本的测定,阳性对照多用确定的病人血清或者以复钙人血浆为原料加入一定量标准品。
如何选择合适的阴性对照?
阴性对照的基本组成也应该尽量与检测样本的组成一致,最好先行检测确定其中不含待检物质。比如,检测人血清标本时,阴性对照应该选择正常人血清;检测免疫动物血清中抗体效价时,阴性对照应该选择该动物的免疫前血清。
如何选择最优化的包被条件?
1.包被抗原的选择
包被抗原可分为天然蛋白、重组蛋白和小分子抗原三大类。天然蛋白需经纯化才能用直接吸附法包被,对于含杂质较多的抗原可以采用间接捕获法包被(先用能够与目的抗原反应的物质如抗体直接吸附在酶标板上,再通过特异性反应使抗原固相化)。经纯化的重组蛋白一般皆可直接包板。小分子抗原比如多肽以及一些小分子有机化合物,由于分子量太小,往往难于直接吸附在酶标板上,一般都先使其与无关蛋白质如BSA等偶联,偶联物吸附于固相载体上。
2.包被液的选择
一般常用的是pH9.6的碳酸盐缓冲液,如果包被的抗原在碱性条件下不稳定的话,也可以使用pH7.2的磷酸盐缓冲液。
3.包被温度的选择
通常是4-8度条件下过夜或者37度保温2小时,我们强烈建议4-8度条件下包被,有利于蛋白活性的保持。
4.包被浓度的选择
包被的最适浓度随固相载体和包被物的性质变化,一般蛋白质的包被浓度为1-5ug/ml,要明确针对特定包被抗原的最适包被浓度需要通过实验来确定。
包板后需要封闭吗?应该选择什么样的封闭体系?
封闭是否必要,取决于ELISA的模式及具体的实验条件。一般说来,双抗体夹心法,只要酶标记物是高活性的,操作时洗涤彻底,不经封闭也可得到满意的结果。而在间接法测定中,封闭一般是必不可少的。
常用的封闭剂有0.05%-0.5%的BSA、10%的小牛血清、1%明胶、5%的脱脂奶粉,AbMART推荐使用5%脱脂奶粉,价廉而且封闭能力强,不过5%脱脂奶粉只适合短期内使用,不宜长期保存,所以试剂盒中较少使用。
如何正确使用酶结合物?
1.酶结合物的稀释液
在稀释液中常加入高浓度的无关蛋白质(例如1%BSA或5%脱脂奶粉),通过竞争抑制酶结合物在固相载体上的非特异性吸附。一般还加入能够抑制蛋白质吸附于塑料表面的非离子型表面活性剂,如吐温20(0.05%的浓度较为适宜)。
2.正确稀释酶结合物
酶结合物的合适工作浓度需要通过预实验来确定,浓度过高易导致本底偏高,浓度过低则会导致阳性信号的减弱。
酶结合物最好在使用前稀释,稀释后的酶结合物不宜长期保存,因为低浓度的酶结合物极易失活。
|
问题 |
可能的原因 |
解决方法 |
|
阴性对照产生了阳性的结果 |
试剂或者耗材污染 |
更换试剂,使用一次性耗材 |
|
洗板出现问题 |
更换更强配方的洗涤液,增加洗板次数,延长洗板时间 |
|
|
如果是在双抗体夹心法中出现,有可能是包被抗体与二抗间有交叉反应 |
更换包被抗体或二抗 |
|
|
使用了过多的抗体 |
减少抗体使用量 |
|
|
整板出现高背景 |
二抗产生了非特异性吸附 |
减少二抗使用量,缩短二抗反应时间 |
|
显色液不新鲜 |
使用现配的显色液 |
|
|
显色反应时间过长没有终止 |
控制显色反应时间,及时终止反应 |
|
|
试剂或者耗材污染 |
更换试剂,使用一次性耗材 |
|
|
反应温度过高导致的非特异性吸附 |
严格控制反应在最适温度下进行 |
|
|
封闭条件不佳导致的非特异性吸附 |
更换封闭能力更强的封闭液,延长封闭时间 |
|
|
反应信号偏低 |
包被条件不合适 |
提高包板浓度,延长包板时间 |
|
抗原抗体反应不够充分 |
延长反应时间,确保反应在最适温度下进行 |
|
|
显色液配方不恰当 |
增加显色底物的量 |
|
|
二抗结合不够 |
提高二抗浓度,延长反应时间,更换效果更好的二抗 |
|
|
梯度稀释做 ELISA 时产生跳孔现象 |
酶标板叠放导致传热不均匀,各孔反应温度有差异 |
尽量避免酶标板叠放在一起 |
|
移液器稀释时未能保持连续性 |
定期校准移液器,确保移液器的正确使用 |
|
|
反应溶液蒸发 |
酶标板用封条密封或者加盖 |
|
|
洗板不均匀 |
确定洗板机能够正常工作 |
|
|
酶标板底有杂物或者水珠 |
读板时清理干净酶标板底部 |