免疫球蛋白(immunoglobulim,Ig)
互联网
免疫系统受抗原刺激后,B细胞转化为浆细胞,由浆细胞产生与抗原发生特异性结合的球蛋白,这类球蛋白称为抗体(antibody,Ab)。
免疫球蛋白(immunoglobulim,Ig)是指具有抗体活性或化学结构与抗体相似的球蛋白。
免疫球蛋白普遍存在于哺乳动物和人类的血液、组织液和外分泌中。人体的免疫球蛋白主要有五类:IgM、IgA、IgG、IgD、IgE。
(一) 抗体结构
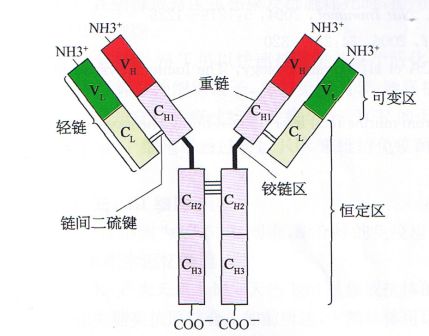
抗体是具有4条多肽链的对称结构,其中2条较长、相对分子量较大的相同的重链(H链);2条较短、相对分子量较小的相同的轻链(L链)。链间由二硫键和非共价键联结形成一个由4条多肽链构成的单体分子。轻链有κ和λ两种,重链有μ、δ、γ、ε和α五种。
整个抗体分子可分为恒定区和可变区两部分。在给定的物种中,不同抗体分子的恒定区都具有相同的或几乎相同的氨基酸序列。
可变区位于"Y"的两臂末端。在可变区内有一小部分氨基酸残基变化特别强烈,这些氨基酸的残基组成和排列顺序更易发生变异区域称高变区。高变区位于分子表面,最多由17个氨基酸残基构成,少则只有2
~3个。高变区氨基酸序列决定了该抗体结合抗原抗原的特异性。一个抗体分子上的两个抗原结合部位是相同的,位于两臂末端称抗原结合片段(antigen-binding fragment, Fab)。"Y"的柄部称结晶片段(crystalline fragment,FC),糖结合在FC 上。
(二)抗体基因重排
抗体的L链是由C、V、J三个基因簇编码的,H链由C、V、D、J四个基因簇编码的。V是编码可变区,有300个种类;D编码高变区,有15
~20个种类;J编码连接V、C的结合区,有4~5个种类;C编码恒定区,仅有一种。这些外显子通过多种多样的重排,所合成出的肽链,还要再进一步进行L和H链组合,这样最后生成的抗体种类就非常多了。抗体基因重排是发生在淋巴细胞分化的时候。
(三) 单克隆抗体(monoclonal antibody,McAb)
克隆选择学说:淋巴细胞在与抗原接触前就已经存在多种多样的与抗原专一性结合的受体,一种细胞带一种受体,进入机体的抗原选择性的结合其中的个别淋巴细胞,使之活化,增殖产生大量带有同样受体的细胞群,分泌同样的抗体。
当抗原进入体内,在机体中就会诱导出针对不同抗原决定簇的多种抗体,如果要把这些抗体一一分开,用现有的生物化学或物理化学方法是根本办不到的。1975年科勒(Koehller)和米尔斯坦(Milstein)将小鼠免疫细胞与肿瘤细胞融合,培养出既能迅速生长繁殖又可分泌特异性抗体的杂交瘤细胞。从而获得针对某一特殊抗原决定簇的单克隆抗体。
(四)抗体的作用
(1)沉淀和凝集
可溶性抗原、细胞表面抗原(血液凝集)
(2)补体反应
(3)K细胞的激活
Ag-Ab结合后,K细胞表面受体能和抗原表面的受体结合,将抗原杀死。
<center> <p> </p> <p> </p> </center>