如何实现精准且高效的动物靶器官基因转染?
汉恒
题记
科研之路,一入侯门深似海,从此悠哉是路人~
实验之殇,雄关漫道真如铁,怎么老是撞到铁
今天,老蔡就陪各位铁兄铁姐啃一块难啃的铁块-如何实现动物体内的基因转染?
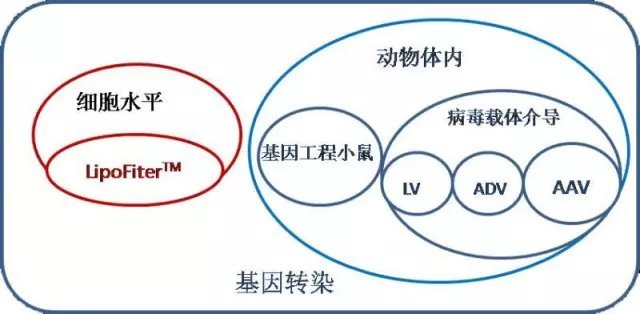
所谓基因转染,通俗一点说,主要指基因上下调(即 Gain of function OR loss of function)。
基因工程小鼠-经典的动物体内基因干预模型
最经典传统的动物体内基因干预,当属基因工程小鼠了。基因工程小鼠包括转基因小鼠,(TG mouse,transgenetic mouse),敲除小鼠(KO mouse,Konckout mouse),敲入小鼠 (KI mouse,Knockin mouse)。在引入 Cre-loxP 系统后,又发展了组织特异性 TG 和 KO 小鼠。
基因工程小鼠对生物医药研究与研发发挥了巨大的作用,但也存在不少的限制因素:
1)从受精卵开始的基因干预,经过发育的长时间复杂代偿,所表现出来的功能表型和实际的基因功能表型可能存在巨大的偏差。2015 年 8 月份,nature 杂志发表了 Didier Stainier 研究小组发现受精卵敲除 egfl7 基因和成年后用 RNA 干扰阻断 egf17 的表达,模式生物所得到的表型完全不一样。
此处链接到那篇原文(参见 Nature 中文摘要)
2)基因工程小鼠周期长,成本相对高。君记否,在动物房里伺候老鼠,一把屎一把尿拉扯它长大,给它找对象,还得帮它养孩子……病毒载体介导的动物体内基因转染
目前最主流的病毒载体工具有三种:腺病毒(adenovirus),慢病毒(lentivirus),腺相关病毒(AAV,adenovirus associated virus)。相比较基因工程小鼠的局限性,病毒载体工具有如下优势:
i) 对成年的动物直接进行急性的基因干预,避免了发育代偿的问题;ii) 病毒载体相对与基因工程小鼠来说,构建包装的周期和维持成本要小得多;iii)病毒载体介导的基因干预可以在动物造模后进行,作为一个基因治疗干预手段,与临床更加接近,而不仅仅是完成基因功能研究。
1)慢病毒载体:慢病毒由于其本身的基因组整合特性,长时间表达,因而在细胞基因转染中被广泛用于建立基因稳转细胞系。但在动物活体(in vivo)水平,慢病毒相比腺病毒和腺相关病毒,劣势明显。
a. 慢病毒滴度的限制:动物体内基因转染对注射的活性病毒载体总量及注射体积都有极高要求,而注射体积往往是容易被忽略但实际上限制最大的因素,如小鼠脑室注射,注射的体积不能超过 2 ul。
同样的病毒注射总量,病毒滴度越高则注射的体积数越小,而比慢病毒由于滴度限制 (108~109TU/ml), 单位体积所含的病毒活性病毒颗粒数相比腺病毒和 AAV 少得多,因此在动物体内(in vivo)基因转染的应用上,慢病毒的转染效果远不如腺病毒和 AAV。
b. 潜在致瘤性:慢病毒整合到宿主细胞的基因组中,形成稳定的且理论上长时间的表达。虽然在实际实验中普遍认为慢病毒是相对安全的,但这种随机插入理论上仍会有接种动物致瘤的潜在危险性。NIH 对慢病毒的安全级别为 RK2+级别,是三种病毒里边最高风险的级别(腺病毒为 RK2 级,AAV 为 RK1 级)。
2) 腺病毒载体:腺病毒载体的特点是滴度高(1011PFU/ml),可插入片段大,侵染广谱,瞬时表达能力强,基因表达所需时间短。腺病毒是第一个用于基因治疗临床实验的病毒载体,在动物体内基因转染也有非常广泛的应用。
腺病毒载体在动物基因转染实验中,特点突出且鲜明:
a. 腺病毒能够在注射干预的 72 小时即开始强烈表达,因而对于一些干预窗口特别短的急性体内基因转染,腺病毒有着显着的优势;b. 腺病毒载体在体内的表达时程为 2-4 周,四周后表达基因表达衰减明显;如需要延长表达时间,可在第一次注射 2 周后行二次注射。
不同剂量的腺病毒载体体内基因转染的起效时间曲线J. KOLLS etc. Proc. Natl. Acad. Sci. USA Vol. 91, pp. 215-219, January 1994/c. 腺病毒有较高的免疫原性,通过系统性给药比较容易激活免疫系统产生相应的抗体,影响体内基因转染效果,因此腺病毒载体更多的是目的脏器的局部注射(肝脏例外)。
最常见的腺病毒载体给药方式为原位多点注射,比如骨骼肌,心肌,肿瘤组织等,一般选取 3-5 个注射点,每个点 10ul 左右的注射量。
3) 腺相关病毒(AAV):动物体内基因转染神器
腺相关病毒,即 AAV,是最优秀最安全的动物体内基因转染工具,相比较慢病毒等其他病毒载体,AAV 有滴度高,免疫原性极低,表达时间长,无任何致病性及病理毒理作用,病毒颗粒小扩散范围广,多血清型且有相对组织亲和性等等优点。
AAV 有多种血清型,每种血清型的靶器官亲和性各不相同,这一点决定了 AAV 与其他病毒载体相比,是更有器官选择性的载体。汉恒生物在原有的 AAV 血清型基础上,开发出更多脏器相对亲和力的 AAV 血清型。
AAV 堪称动物体内基因转染神器,汉恒团队有丰富的 AAV 血清型开发及应用经验,从心脏、肝脏、脑区、肺、肾脏、消化道,到肌肉、血管、眼部、内耳、睾丸,结合汉恒团队积累的多器官注射方式,帮助科学家们实现多脏器的高效基因转染。