《Cancer Cell》伯豪客户肿瘤外泌体研究新成果
丁香园
肿瘤外泌体RNA通过激活肺泡上皮TLR3招募嗜中性粒细胞促进肺预转移微环境形成
研究背景
1889年,Stephen Paget通过对大量肿瘤的解剖学研究发现,特定的肿瘤细胞总是倾向于转移到特定的组织器官。假说认为肿瘤细胞只能在适宜的组织器官环境中才能形成转移灶。尽管该发现意义重大,此种现象产生的原因却直到2015年才最终得到解答。
Nature杂志在2015年在线刊登了M.D. Anderson癌症中心的Dihua Yu等的最新研究发现,研究人员以神经胶质细胞为研究对象,认为神经胶质细胞分泌的外泌体会改造转移到脑部的肿瘤细胞,提高肿瘤细胞的抗凋亡能力。
由此,人们在感叹百年前科学家就已经提出如此重大理论的同时,也渐渐认识到外泌体在肿瘤细胞转移过程中对预转移微环境(pre-metastatic niche)影响的深远意义。然而,这还远不是研究的终点。外泌体影响肿瘤预转移微环境的具体分子机制还依然有待探索。
2016年8月8日,国际著名肿瘤学术期刊《Cancer Cell》(IF:23.214)杂志在线刊登了我国肿瘤研究领域著名科学家,第二军医大学免疫学研究所所长,中国医学科学院院长曹雪涛院士在肺癌研究中的最新研究成果.
题为:Tumor Exosomal RNAs Promote Lung Pre-metastatic Niche Formation by Activating Alveolar Epithelial TLR3 to Recruit Neutrophils。
该研究首次提出了肿瘤外泌体中的RNA通过激活肺泡上皮细胞(Lung epithelial cells)TLR3(Toll-like receptors)蛋白招募嗜中性粒细胞促进肺预转移微环境形成,从而促进了肿瘤细胞的转移。该工作也为人们进一步认识外泌体对肿瘤转移的深远影响提供了科学依据。
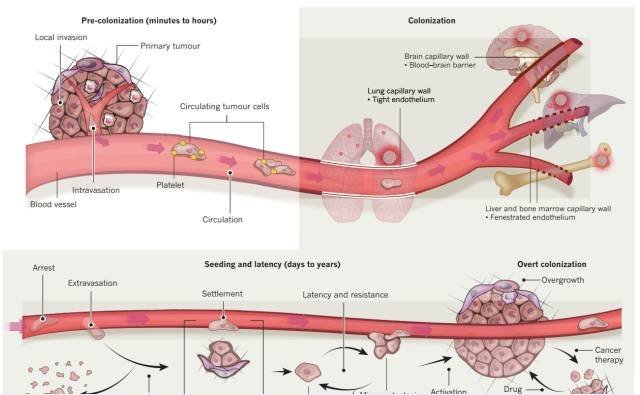
肿瘤转移(Tumor metastasis)是肿瘤导致死亡的重要原因,包含了肿瘤细胞从原发灶到其它环境转移的全部过程。其中每一个步骤都需要肿瘤和其所在的微环境的相互适应。
原发肿瘤细胞通过促进适合细胞转移的微环境的产生,这种微环境也被称为预转移微环境(pre-metastatic niche)。具体的来讲,骨髓源性细胞(bone marrow-derived cells, BMDCs)受到原发性肿瘤因子的动员,诱导产生适合肿瘤转移的预转移微环境,帮助肿瘤细胞转移到目的器官。
其中,肿瘤细胞核目的器官之间关联的具体分子机制还不完全为人所知。
在此,研究人员以肺癌上皮细胞的癌转移为研究对象,通过对模式识别受体(Pattern-recognition receptors, PRRs)中研究最多的TLRs 进行基因敲除以及激活观察其表型变化,结合已有文献报道,从而发现外泌体在其中的重要作用。
通过外泌体全转录组RNA测序实验,进一步对外泌体中影响肿瘤转移的RNA进行了进一步鉴定。最终,研究人员还成功地将已有的研究成果在临床中得以应用。
研究思路
研究结果
1. TLR3缺失抑制肺预转移微环境形成以及癌细胞转移
研究人员为了对TLR3,TLR4以及TLR9这些TLRs有总体的了解,对基因敲除的小鼠和野生型小鼠进行了Tlr3,Tlr4以及Tlr9的Lewis肺癌 (LLC) 或者B16/F10黑素瘤细胞接种,随后进行表型观察。
结果发现,Tlr3小鼠相比较野生型,癌细胞扩散速度较慢,Tlr3小鼠生存时间也相比而言更加长。对微环境有关基因,如Bv8(Prok2),S100a8,S100a9以及Mmp9定量PCR检测发现,其表达量均在Tlr3中显著下降。
2. TLR3缺失降低嗜中性粒细胞招募至肺组织
由于BMDCs会被招募到转移器官中形成转移微环境。因此,研究人员还对肺的Tlr3以及野生型进行了细胞组分观察。结果发现,野生型细胞组分与Tlr3细胞组分相差甚大。
野生型细胞中,CD11b+ 骨髓细胞在预转移的肺中显著扩散,CD45+ CD11b+ Ly6G+ Ly6Cint 嗜中性粒细胞大量富集。Ly6G Ly6C+ 以及F4/80+ 巨噬细胞也有适度富集。与之相反,Tlr3缺失则降低嗜中性粒细胞招募至肺组织。
3. 肿瘤来源的外泌体调控肺上皮TLR3活性
在之前研究中,人们发现原发癌诱导产生系统性的微环境变化是通过外泌体介导的。为了对TLR3在调控预转移微环境中的影响有一定的了解,研究人员对肿瘤来源的外泌体进行了进一步研究。通过对外泌体蛋白含量的检测以及趋化因子和其它表型的观察等,结果发现,肿瘤来源的外泌体调控肺上皮TLR3活性。4. 外泌体通过其RNA激活TLR3
研究人员进一步对外泌体激活TLR3的分子机制进行了研究。已有研究表明,外泌体中含有大量的非编码RNA。此外,TLR3不仅可以识别来源于病毒的dsRNA还可以识别来源于组织损害的dsRNA,研究人员抽提了肿瘤来源的外泌体来鉴定激活TLR3的调控因子。
结果表明,肿瘤来源的外泌体RNA通过NF-kB以及MAPK在AT-II细胞中上调TLR3的表达,并且导致趋化因子产生以及嗜中性粒细胞招募从而产生预转移微环境。
5. snRNA在肿瘤外泌体中座位TLR3的配体大量富集
外泌体中RNA种类丰富,为了确定和TLR3激活相关的外泌体RNA,研究人员采取了针对外泌体的small RNA以及lncRNA转录组测序(该工作由上海伯豪生物技术有限公司完成)。其中,肿瘤细胞RNA作为对照。
有趣的是,研究人员发现外泌体RNA片段长度基本低于200bp。此外,研究人员还发现,外泌体RNA 70%由非编码RNA组成。在Rfam数据库已知的非编码RNA中,tRNA与snRNA占比最大,并且在外泌体中,富集程度显著高于肿瘤对照组。与此同时,重复序列RNA(SINE,LINE,LTR等)贡献了绝大多数已知的非编码RNA。
其次,研究人员还对出了tRNA外其他的非编码RNA进行了深入研究,结果进一步证实了snRNA是肿瘤来源外泌体中富集程度最高的几个种类之一。TLR3之前被认为通过识别U1 snRNA在UV辐射的免疫应答中起作用,而在测序结果中,研究人员发现,U1 snRNA在肿瘤外泌体中富集程度超过1000倍。这些snRNA都具有类似的二级双链茎环结构。
6. TLR3高表达预示肺癌预后较差
研究人员为了将该项研究结果和临床相结合,最后又对90个肺癌患者样本进行研究,确定TLR3表达量以及嗜中性粒细胞的渗透和肿瘤周边组织与临床结果的关联。结果发现,TLR3高表达往往伴随大量嗜中性粒细胞的渗透。
同样,TLR3高表达以及嗜中性粒细胞高渗透性与S100A8和S100A9的高表达也是相关的。TLR3的高表达最终导致了肺癌患者的高死亡率。
小结
预转移微环境的产生对器官特异的转移趋向性是极其重要的。研究人员使用内源的转移模型,首次发现了肺上皮细胞TLR3通过肿瘤外泌体对嗜中性粒细胞的招募在促进肺预转移微环境过程中的重要作用。
在肿瘤外泌体中富集的snRNA在肺泡Type II上皮细胞中激活TLR3导致趋化因子分泌以及促进了嗜中性粒细胞得以被招募。在人类肺癌中,临近的组织高表达TLR3与嗜中性粒细胞高度渗透有着极高的关联性。两者都可以代表着患者预后较差。因此,本项研究为肿瘤预转移微环境形成以及器官特异性转移提供了新的认识。