腺病毒纯化AAV8完整和空壳分离新办法
上海精瑞科学仪器有限公司
现状
基于腺相关病毒(AAV)的各种血清型载体被公认在人类基因治疗和基因疫苗接种应用中具有高潜力。在制造AAV载体期间,不必要的,不完全的颗粒共同产生。它们缺乏重组病毒基因组,仅由空衣壳蛋白组成。空衣壳增加了用于医学应用的AAV病毒的所需剂量,并且被认为引起针对载体衣壳的免疫反应,导致不必要的副作用。因此,在制造过程中去除空衣壳以及量化制剂中空AAV颗粒含量的能力是任何AAV生产过程的关键要求。
❀ 制备AAV载体的常规方法
目前用于制备分离空衣壳(CsCl或碘克沙醇梯度)的方法对于放大是具有挑战性的并且不适合于大规模生产。此外,用于检测空衣壳的分析方法和全空粒子比的测定(电子显微镜(EM)测定,总粒子测定[ELISA]结合基因组拷贝滴定[qPCR])耗费时间和劳动力,受操作者的影响技术或不提供用于不同血清型AAV的容易获得的试剂。
❀新突破
本应用简报介绍了利用微小电荷差异分离全空和空AAV8颗粒的新方法。通过在BIA Seperations 的CIMmultus™ QA Monolithic column整体柱上使用线性梯度洗脱,引入了用于分析AAV颗粒的简单,快速和可重复的分析。该方法成功应用于通过两种不同制造工艺制备的AAV8颗粒。
材料与方法
通过CsCl梯度离心制备纯化的完整和空AAV8载体颗粒的病毒制剂。
通过切向流过滤(TFF)然后通过碘克沙醇梯度进行AAV8的替代制备。

结果
电子显微镜
通过电子显微镜分析AAV8制剂制剂中完全和空颗粒的存在。 空壳用箭头表示(图1)。

全衣壳和空壳AAV颗粒的色谱分离
用完整和空AAV8载体颗粒的CsCl梯度制备物进行初始结合 - 洗脱实验。 线性盐梯度下的不同保留体积表明可以对全载体和空载体颗粒进行色谱分离(数据未显示)。
基于这些结果,将全粒子和空粒子的混合物应用于CIMmultus™ QA Monolithic column整体柱(图2)。 将任意体积的75μL空衣壳制剂与1×10 12 GC的含有93.7%完整AAV载体颗粒(通过EM测量)的制剂混合(图2)。
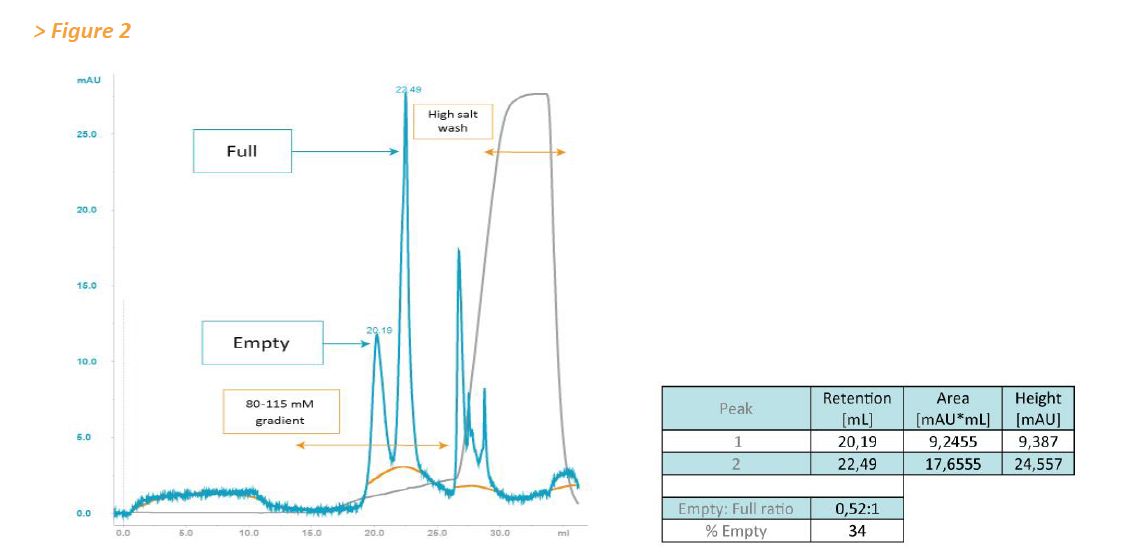
检测到代表空衣壳和完整衣壳的明显可区分的峰。 后来的洗脱峰含有> 99%的负载的全颗粒(通过qPCR测定)。 空衣壳的计算相对量(根据测量的峰面积)为34%(图2)。
然后使用AAV8衣壳的色谱分离来分析不同AAV制剂中的全粒子与空粒子比率。 基于色谱峰积分,通过CsCl梯度(通过EM测量的93.7%饱和度)对AAV制剂的定量导致空 - 满比率为0.016(1.6%空颗粒),而0.067(空颗粒为6.28%) 由EM分析确定(数据未显示)。
通过替代方法产生的AAV颗粒的色谱分离和定量
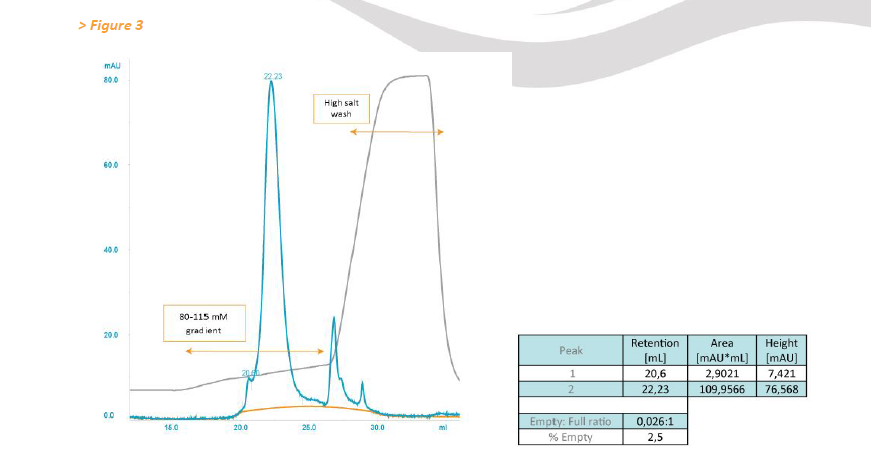
接下来评估基于CIM QA的分离和定量的适用性,用于替代的AAV制备(通过TFF制备,随后是碘克沙醇梯度)。 将含有相当于5×10 12 GC的AAV制剂加载到CIMmultus™ QA Monolithic column上,并用线性梯度洗脱分离,如色谱图所示(图3)。 与由CsCl制备的AAV相比,加载的AAV颗粒多5倍(图2),这导致洗脱峰变宽。 在20.0分钟洗脱的次要峰的峰面积与在22.2分钟洗脱的主峰的积分(图3)表明空 - 满比为0.026(2.5%空颗粒),与EM获得的比例很好地一致( 空 - 满比率为0.05;空颗粒为4.5%)。
为了证明该方法对不同AAV生产过程的适用性,AAV样品掺入空颗粒制剂,使用相同的梯度条件注入CIMmultus™ QA Monolithic column(图4)。
分离和定量AAV颗粒(TFF和碘克沙醇梯度),加入空衣壳AAV

❀结论:
开发了一种快速,可重复的方法,用于在CIMmultus™ QA Monolithic column上通过线性梯度洗脱分离和定量空颗粒和全颗粒AAV8载体。 该方案成功地用于两种不同的AAV制剂,并且能够定量空衣壳含量,这与替代方法一致。 色谱方法的优点是简单,快速,不依赖于操作员技术和需要专门的试剂。 相反,它在单次测定中提供粒子特征的定量分析,运行时间为30分钟。
上海精瑞科学仪器有限公司
BIA Separations 一级代理
159 0176 2218(vx同号)