包涵体蛋白的复性
中科森辉微球技术(苏州)有限公司
概要
对于基因工程技术构建的重组蛋白,通常分为可溶性重组蛋白和不溶性重组蛋白,可溶性的重组蛋白一般常常存在于细胞质内、细胞分泌到培养基、分泌到周质间隙中等。不可溶性的蛋白主要是由于表达系统的高效表达,在细胞内形成了包涵体。E.coli是应用最为广泛的重组蛋白质表达系统,但是表达的外源性蛋白多以包涵体的形式存在,为了重新获得生物活性,需要对包涵体蛋白质进行体外变复性操作。
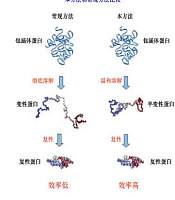
蛋白质复性模型
包涵体蛋白的复性
包涵体蛋白的复性步骤主要包括裂解、洗涤、溶解、复性。
裂解
大肠杆菌经发酵后,表达的外源蛋白多以稳定的包涵体形式存在于细胞质中,将其提取出来方法多采用超声破碎法,而由于超声处理量的限制,生产工艺一般采用高压均浆破碎,破碎后大肠杆菌的包涵体可采用离心收获。
洗涤
包涵体常用的洗涤试剂为中性去垢剂和还原剂。包涵体中主要由重组蛋白组成,同时也含有一些外膜蛋白(Omp C、Omp F、Omp A)、16S 和 23S、5S的r RNA、质粒 DNA 和其它杂质。去除这些杂质,可采用去垢剂 Triton X-100、脱氧胆酸盐和低浓度的变性剂等对包涵体充分洗涤。包涵体洗涤的洁净程度,对于后续的纯化步骤十分重要,包涵体纯度高,可以大大降低后续的纯化压力。但是,变性剂尿素的使用应该注意的是大肠杆菌外膜蛋白Omp T(37 kD)在4~8 mol/L 尿素中具有蛋白水解酶活性,在包涵体的溶解和复性过程中会引起蛋白质的降解。
溶解
变性剂盐酸胍/尿素是包涵体常用的溶解试剂,通常还会加入一些去污剂(NLS、CTAB、SDS) 和还原剂(巯基乙醇、二硫苏糖醇等)。它们通过改变蛋白质的结构,打开蛋白质肽链。由于包涵体是部分折叠蛋白质聚集而成的具有天然或天然样构象的二级结构。如在适合的条件下将其溶解变性,这些天然样构象的二级结构将不被破坏而保留,这样将更利于复性工艺中的蛋白质回收。部分学者认为,高浓度的变性剂(盐酸胍等)能够完全破坏掉蛋白质的天然结构。因此,要保留天然的二级结构必须采用温和的溶解方法。例如,应用低浓度的尿素对包涵体进行温和处理,可保留目标蛋白的少量二级结构。
包涵体的复性
复性是指在氧化还原的状态下,去除溶液中的变性剂,使得无活性蛋白质恢复活性,重新获得空间构象的过程。目前,已经有很多种方法用于体外复性,每一种复性方法都有其自身的应用特性。
传统的复性方法如稀释方法、透析法复性都存在效率低的问题。为了防止复性过程中聚集体的形成,复性蛋白质的终浓度一般控制在很低的水平,通常小于0.1 mg/ml,因此会带来庞大的复性体积。
色谱法即柱上复性法是利用层析介质与蛋白质的特异性结合,在空间上隔开蛋白质分子,防止其在折叠时相互接触形成聚集体。层析复性可以提高蛋白质的终浓度,而且对目标蛋白具有纯化作用。柱上复性有可能会失败,不排除复性过程中蛋白质分子可能会形成聚集沉淀造成层析柱堵塞。