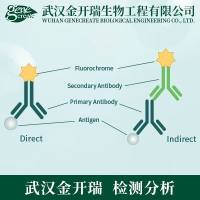
材料与仪器
步骤
一、常规操作方案
下面这个典型流程对许多蛋白质都有很好的效果。本 操 作 方 案 是 根 据 N g u y e n 等(1993)首先开发的方案改编而成,并用于冷泉港蛋白质纯化与鉴定课程的不溶性重组蛋白纯化部分(Burgess and K n u t h , 1996)。其他类似的流程也可能给出相似的结果,但我们实验室几乎只使用该流程。下面我们将会对关键步骤进行讨论。
(1) 使 用 含 有 I L L B 培养基的2 L 培养瓶, 在 37°C 、振摇条件下培养携带了 p E T 载体 (克隆有目标基因)的 大 肠 杆 菌 B L 21(D E 3)p L y S 菌 株(Studieretal., 1”0), 直 A600nm达 到 0.6。
(2) 加人异丙基-β-D-硫化半乳糖苷(I P T G ) 至 0. 5〜 I m m o l /L ,诱 导 T 7 R N A 聚合酶的表达,然后该酶进行目标基因的转录。
(3) 诱 导 3〜4 h 后 ,15 000 r/min 离 心 15 min以收获细胞,用小体积的培养上清液重悬细胞,然后将其转移至预先称重的40 mL橡树岭(Oak Ridge)离心管中, 离心以沉淀细胞。记录细胞沉淀的湿重,并冻存于一80°C 待用 。用 此 方 法 一 般 每 升 可 得 到 1.5〜2.0 g湿重的大肠杆菌细胞。
(4) 解冻细胞,用 30 m L 裂解缓冲液[50 m m o l / L Tris-H C l (p H 7. 9),0.1 mmol/ LEDTA,5% 甘油,0.1mmol/L DTT,0.1mol/L NaCl]重悬,然 后 用 60% 的 功 率 超 声 3次或 4 次 ,每 次 20 s ,每次间隔 I m i n 于冰上冷却。
(5) 加入纯的 Triton X -100(来 自 1 0 % 的质量体积浓度的储存液)至 1 % 以分解细胞膜和溶解膜蛋白。将裂解物于冰上孵育10 m i n ,然 后 15 000 r A n i n 离 心 15 m i n 以沉淀包涵体 ,最后移走可溶性上清液。
(6) 用 30 m L 含 1 % Triton X -100的裂解缓冲液重悬包涵体,冰上孵育10 m i n ,然后15 000 r /m i n 离心 15 m i n 。
(7) 将去除了上清液的包涵体沉淀用30 m L 不 含 Trinton X -100的裂解缓冲液重悬以去除 Trinton X -100, 然后同上条件离心。得到的沉淀称为洗涤后的包涵体成分,其纯度通常高于9 0 % 。
(8) 将洗涤后的包涵体沉淀重悬于合适的变性剂,并 孵 育 使 之 变 性 和 溶 解 ,然后15 000 r/m i n 离 心 15 m i n 以除去任何残余的不溶物。我们通常使用上述裂解缓冲液 (如果 用 盐 酸 胍 稀 释 则 不 含 N a C l ) ,同 时 加 人 6 m o l/L 盐 酸 胍(guanidine hydrochloride,G u H C D ,8 m o l/L 尿素(urea)或 0 . 3 % 十 二 烷 基 肌 氨 酸 钠 [或 称 为 N -月桂酰肌氨酸钠(sarkosyl 或 n-lauroyl sarcosinate)]以使包涵体溶解。
(9) 最近,我们采用了一种相对简单的重折叠实验(见下文)以鉴定出合适的重折叠缓冲液。
(10) 将变性样品中的蛋白质浓度调整至I m g /m L 。
(11) 将变性蛋白质稀释15〜6 0 倍, 以使变性剂浓度降低至蛋白质可以进行重折叠的程度。通常我们或是快速地稀释,或是缓慢地将变性的包涵体蛋白滴加至烧杯中的重折叠缓冲液中,同时剧烈搅拌以快速混匀。稀释过程在室温下进行,混匀完成后, 将溶液静 置 1〜2 h 以保证重折叠过程的完成,同时也使聚集物形成并出现絮凝物。
(12) 用蛋白质低亲和的 0. 22um 滤膜(如 Stericup——GV 0. 22 m m o l /L , 500 m L ,Millipore # S C G V U 05R E )过滤重折叠的蛋白质溶液以去除颗粒状物质(如果有明显的沉 淀 ,其可能会堵塞滤膜,可在过滤之前进行离心)。
(13) 将过滤后的溶液尽可能快地(要在柱子和系统压力限制容许的范围内,希望至少 10 mL/min)栗 入 10〜 15 m L 的 离 子 交 换 层 析柱 。如 果 条 件 允 许 ,监 测 280 nm、260 nm和 320 m n 处的吸光度。其 中 320 n m 处的光吸收用于测量光的散射, 对于某些蛋白质来说,它可显示多聚体形成的峰。
(14) 用 5〜1 0 个柱体积的添加了 〇• I m o l / L N a C l 的 缓 冲 液 A [50 m m o l / L Tris-HCL(pH 7 . 9 ) ,5 % 甘 油 ,〇 . 1 mol/L EDTA, 0.1mmol/L DTT] 冲 洗 柱 子 ,然 后 用 1 0 个柱体积的在相同缓冲液中的0. 1〜1. 0 m o l / L N a C l 的线性梯度洗脱,流 速 为 5 m L /m i n ,每 份 收 集 3〜4: m L 。
(15) 用 S Ds- P A G E 分 析 280 n m 的吸收峰, 确定不同收集组分的纯度。如果能够进行酶活性分析,那么分析各收集组分以确定具有最髙特异性活性的组分。
(16) 混合各收集峰,用 含 5 0 % 甘油的裂解缓冲液透析,然后冻存于一20°C 或一80°C 。
(17) 鉴定混合的收集峰。如果可能, 将其特异性活性与该蛋白质标准样品的活性进行比较,该标准品的制备使用的是不涉及重折叠的更常规的方法。
二、对该常规操作流程的评论
1. 大肠杆菌中重组蛋白的过表达
获得高水平表达与重折叠是不同的主题,在此不会进一步讨论(可见本部分的第12章 )。许多系统可以获得占总细胞蛋白质1 0 % 〜4 0 % 的目标蛋白质表达水平(Mak r i d e s,1996; M u r b y et al., 1996; Sorensen and M o r t e n s e n, 2005; Studier et al,, 1990)(见本章 第 9 节)。通常 ,研究者需要做实验以确定在什么温度下培养细胞、使用多少诱导剂以及诱导多长时间。当目标蛋白质实现髙水平的诱导表达后, 通常会将细胞离心,然后冻存于一80°C 待用。有些说法认为,将细胞冻存数周会使得包涵体难以重折叠,但据我的经验 ,我们可以使用冻存了数月的细胞做出很好的重折叠效果。然而遗憾的是, 据我所知,
尚无系统的研究探讨这一问题。
2. 包涵体的洗涤
我 们 最 初 用 2 % 的 去 氧 胆 酸 钠(sodium deoxycholate)洗 涤 包 涵 体(Burgess andKrmth, 1996; N g u y e n e t a l ., 1993) ,但后来发现1% 的 Triton X-100效果更好、使用更方便 。强 烈 推荐大家使用我称为「美食家」(g o u r m e t) 的 Triton X-100[Pierce,Surfact A m p s X -100, 1 0 % (m /V )溶液], 其经过纯化除去有时会在旧的淡黄色瓶子里保存的T r i t o n X -I O O 中发现的过氧化物后,保存在密封于安瓶瓶(am p o u l e) 的氮气中。可以尝试用不同的盐和去污剂作用以观察哪一种能够更有效地洗出包涵体中的杂质,而同时又不会溶解目标蛋白质,有时候也可以用1〜2 m d /L 的尿素洗涤。一般来说,在溶解包涵体之前,需要洗掉尽可能多的膜成分、D N A 及其他蛋白质。
3. 包涵体的溶解
如之前所说,有 些 包 涵 体 蛋 白 接 近 天 然 状 态 ,用 温 和 的 条 件 ,如 非 离 子 去 污 剂(nonionic detergent)或者甚至 0•5 m o l / L N a C l 就可以将其溶解(V e r a et al., 2006)。大多数情况下,这种做法是不行的,而是需要使用更强烈的变性条件。
与前面的裂解缓冲液一样,促溶剂/变性剂(solubilizing agent/denaturant) —般溶于缓冲液中,以控制 p H 、螯合重金属以及维持还原的环境。通常 ,用促溶剂重悬包涵体, 孵育 30〜60 min,然后离心除去不溶的物质。由于包涵体中的蛋 白 质 至少是部分变性的,所以溶解可在室温下操作,有时甚至需要给溶液加热以实现完全溶解。例如,当把天然的
绿色突光蛋白(green fluorescent protein,GFP)溶 于 6 m ol/L 盐 酸 胍 时 ,在室温下其仍然具有荧光,但 在 75°C条 件 下 ,其 会 在 I mi r i以 内 变 性 并 失 去 荧 光(R. Burgess和 N.T h o m p s o n ,未 发 表 的 结 果)。 对 促 溶 作 用 更 详 细 的 论 述 可 参 考 Marston和 Hartley(1990) 的文献。
下面是对几种促溶剂使用上的评论。
(1)盐 酸 胍 它 可 能 是 最 常 用 的 促 溶 剂 ,通常 其 在 相 容 缓 冲 液 中 的 使 用 浓 度 为6 m o l /L 。在这种强的离液剂中 (chaotropicagent),大部分蛋白质会迅速变性,但许多时候在较高温度下孵育会有助于实现蛋白质完全变性。一旦溶解后,稀 释 至 3 m o l /L 盐酸胍通常也没有问题, 因为从变性状态到天然状态的变化通常发生于1〜2 m o l /L 盐酸胍的水平 (P a c e, 1986)。通常稀释至约0.1 m 〇l/L 盐酸胍就可以实现足够低的盐水平,以保证重折叠的目标蛋白质结合于离子交换层析柱 (见下文)。
(2) 尿 素 8 m o l / L 尿素是常用的促溶剂,尤其用于在变性状态下进一步纯化目标蛋白质( K r m t h and Burgess, 1987)。 一 般 8 m o l / L 尿素在促进蛋白质溶解和使蛋白质完全变性方面不如 6 m o l / L 盐酸胍那么有效。必须注意到总是存在于尿素溶液中的氰酸盐(cyanate) 可能引起蛋白质的氨甲酰化(carbamylation)(本 书 第 4 4 章对如何尽量降低尿素中的氰酸盐提出了建议)。
(3) 十二烷基肌氨酸钠或十二烷基磺酸钠(sarkosyl或 S D S ) 研究者发现, 十二烷基 肌 氨 酸 钠 作 为 有 效 的 促 溶 剂 ,能 够 帮 助 蛋 白 质 在 更 高 的 浓 度 下 重 折 叠(Burgess,1996)。十二烷基肌氨酸钠是一种很强的阴离子变性剂, 很像S D S ,但其与蛋白质结合得更 弱 ,比 S D S 更易解离。通常包涵体可以溶解于0. 3% 的十二焼基肌氨酸钠, 但必须注意的是不能用十二烷基肌氨酸钠溶解等于或超过自身重量的蛋白质。例 如 , 如果你要溶解含 有 150 m g 目标蛋白质的洗涤过的包涵体, 用20 m L 0. 3 % 的十二烷基肌氨酸钠(60 m g十二烷基肌氨酸钠)不能溶解完全。你必须加人至少50 m L 0•3 % 的或者30 m L 0. 5 % 的十二烷基肌氨酸钠。
我们注意到, 如果在包涵体中存在许多Triton X -100,那么需要更多的十二烷基肌氨酸钠来溶解目标蛋白质。几乎可以确定,其 原 因 是 Triton X -100可以形成大的微团, 并且可以吸收一些十二烷基肌氨酸钠形成混合微团,而微团是没有促溶解作用的。
如 果 将 0. 3% 的十二烧基肌氨酸钠溶解的目标蛋白质稀释至约0•01 % 的十二焼基肌氨酸钠, 大部分十二烷基肌氨酸钠就会从蛋白质上解离下来, 蛋白质就会重折叠。残余的去污剂似乎是与部分重折叠的蛋白质的疏水区(黏性位点)结合,从而阻止聚集作用。其就 如 同 化 学 伴 侣(chemical chaperone)— 般 发 挥 作 用 。如 果 你 的 目 标 蛋 白 质 能 够 和P O R O S H S 之类的阳离子交换柱(cation-exchange c o l u m n)结合, 那么稀释后的溶液可以经过过滤,然后泵人1〇 m L 的柱子,用 10〜2 0 个柱体 积 的 0.1 m o l /L 的 N a C l 缓冲液冲洗 ,然后用盐浓度梯度洗脱(见 本 章 5. 5 节),目标蛋白质将会结合在柱上,而游离的十二焼基肌氨酸钠则会流穿,结合在蛋白质上的残余的十二烷基肌氨酸钠也会在长时间冲洗中解离。对洗脱蛋白质的实验分析表明,蛋白质中基本上没有(10个蛋白质分子中少于1个十二院基肌氨酸钠分子)残余的十二烷基肌氨酸钠(R . B u rgess, 未发表数据)。不要
用 M o n o S 柱做此工作,因为十二烷基肌氨酸钠会同该柱子结合,并损坏柱子,而且会污染你的洗脱蛋白质。
SDS也可以以类似的方式使用,但必须注意的是,使 用 的 SDS不能含有长的链烷烃(alkane),如 C14、C1 6 等 。用 在 S D S 中 变 性 的 G E P进 行 的 重 折 叠 实 验 效 果 很 好(R.Burgess、N. Thompson和 R. Chumanov, 未发表数据),因此应该考虑使用SDS作为有效的促溶剂。
已有相关文献报道利用阳离子变性剂氯化十六烷基三甲基铵(cetyltrimethylammo-nium chloride,CTAC)成功实现了蛋白质的促丨谷和重折叠 (Puriet al.,1992)。 即使是盐浓度非常低的蒸馏水也能取得促溶效果(S o n g , 2009)。
4. 重折叠
假设你已经按如下方法进行了重折叠实验,那么最基本的稀释变性剂的方法就是将溶解的蛋白质稀释入合适的重折叠缓冲液中。然而,这 里 有 3 种方法可用于重折叠稀释。
(1) 反向稀释(reverse dilution) 将重折叠缓冲液加至变性蛋白质中,每次加时都要混 匀 。该方法已有数个成功的例子[如G r i b s k o v和 B u r g eSS(1983)]。然 而 ,仔细想想就会知道,这种稀释方法无疑会在蛋白质开始重折叠的关键时期产生最髙的蛋白质浓度。例 如 ,如果蛋白质以I m g /m L 的浓度溶解于6 m o l /L 盐酸胍,那么如果加入2〜5 体积的重折叠缓冲液(稀 释 至 1〜2 m o l / L 盐酸胍),就可能会在蛋白质浓度为 330〜160 ug/mL时经历重折叠的过渡状态。
(2) 瞬间稀释(flash dilution) 将变 性 蛋 白 质 快 速 加 入 重 折 叠 缓 冲 液 。例 如 ,将10 m L 6 m o l /L 盐酸胍中的重折叠蛋白质一次性加入590 m L 的合适的重折叠缓冲液中以稀释60倍, 同时快速混匀。在重折叠时, 蛋白质浓度会成为16ug/m L ,远低于反向稀释的水平,导致蛋白质聚集的可能性较小。
(3) 滴注稀释(drip dilution) — 滴一滴地非常缓慢地将变性蛋白质滴人重折叠缓冲液中,滴加需要 I h 。理论上, 这应当是最佳的方法,因为蛋白质总是在极低的浓度下进行重折叠[参见S i n g h 和 P a n d a (2005) ,Vallejo和 Rinas(2004)的综述]。例如,如果你将 0.1 m L 上述溶解的蛋白质滴入590 m L 重折叠缓冲液中,那么蛋白质浓度只有〇.16ug/m L。因为你滴入的样品量增加得很少,所以蛋白质总是保持在低浓度, 而且当最后一滴被加人时,蛋白质浓度为16ug/m L。然而 ,如果变性蛋白质经过了 I h 的滴加,而且蛋白质有效地重折叠至天然状态的半数重折叠时间只有1〜3 m i n ,那么部分重折叠的黏性蛋白的浓度总是很低,因而它们就不会发生聚集。耗 费 i h ,一滴一滴加人溶解蛋白,这会让人感到厌烦,但可以使用设置为极低流速的蠕动泵将变性蛋白质在I h 这段时间内加人。这样做的重复性更好,而且显著减少了研究生的精力消耗。
蛋白质稀释后将其静置30〜60 m in,然后按常规流程中介绍的那样进行过滤。否则 ,当将蛋白质溶液上样至柱子 (见下文)时,非常小的颗粒状的物质就可能会堵塞柱子,引起压力升高,从而使实验中途失败,或是需要将流速降得很低以至于上样就要花费数小时。
5. 高 分 辨 率 的 离 子 交 换 层 析
蛋白质经过重折叠和过滤后,最后一步的高分辨率离子交换层析柱用于完成 下 面 5项重要工作。
⑴ 浓 缩 蛋 白 质 ( 如 从 600 m L 浓 缩 到 4〜 8 m L )
(2) 去除变性剂(在流穿液中)
(3) 去除次要的杂质(在流穿液中,或是与柱子的结合弱于或强于与目标蛋白质的结合) 如果使用高分辨的阴离子交换柱,如 p〇 R〇 s H Q 或 M〇 n〇 Q,任 何 D N A 污染物都会紧密结合在柱子上,使用〇 • 6〜〇 • 9 mol/L 的 NaCl可以洗脱下来。如果非常希望在终产物中没有大肠杆菌的脂多糖,可以在开始用盐浓度梯度洗脱之前用异丙醇 (isopropanol)冲洗柱子以大大减少LPS。
(4)选择均一的,有活性的单体如果有通过非重折叠技术纯化的天然蛋白质的样品,那么就能知道在同样的离子交换柱上用何种盐浓度可以将其洗脱。如果在相同的盐浓度下,重折叠样品洗脱出了一个主要的峰(peak), 那么就可以部分地确信该蛋白质得到了正确重折叠,因为如果使用的柱子具有高分辨率,那么错误折叠的分子可能会有(但不是一定的)略微不同的洗脱结果。
(5) 除去可溶的蛋白质多聚体在重折叠样品中常有可溶的多聚体(见 本 章 5.7节)。如果你选择的重折叠溶液很合适, 那么多聚体也可能会极少; 否则,它们会是重折叠产物的主要成分。这 些 可 溶 的 N 聚体与单体相比带有JV倍的电 荷 。由于有更多的电荷 ,其倾向于与离子交换柱结合得更紧密,洗脱下来也更晚。如果蛋白质是用于结晶以测定结构,去除多聚体是很重要的一步, 因为不均一相的材料不大可能结晶。
以我的经验,大多数情况下,从柱子中洗脱出的第一个主峰中的蛋白质都会是髙品质的、纯的、具有完整生物活性的蛋白质。
6. 再 氧 化 以 形 成 正 确 二 硫 键
如果你的蛋白质不含半胱氨酸,这就不是问题。然 而 , 大部分蛋白质都含有半胱氨酸 ,而且许多都有作为三维结构重要组成部分的二硫键。由于大肠杆菌的胞质是还原性很强的环境,大部分内源蛋白质都处于还原状态。如果你向裂解缓冲液中加入还原剂,如0.1〜 I rmnolZL的 D T T ,你通常可以使蛋白质保持在还原状态,防止其在上述的再折叠的早期步骤中形成不想要的或不正确的二硫键。然而,只要你重折叠目标蛋白质,如果其能够形成二硫键,你就必须在某些阶段允许蛋白质的再氧化以形成二硫键。含有半胱氨酸 ,但一般不含二硫键的蛋白质中, 其半胱氨酸未处于形成二硫键所需的精确的几何构型中 [见 A nthony等 (2002)]。因此,虽然经常会存在大量可能的错误的二硫键,但其并不会轻易形成。最好的策略是在氧化还原缓冲液(redox buffer) 中进行蛋白质的重折叠。这种缓冲液(见下文)含有还原剂和氧化剂的混合物,可 以 允 许 二 硫 化 物 发 生 「洗牌」(shuffling)[见 G ilbert(1994)]。二硫化物的「洗牌」是由二硫键反复形成和还原组成的。如果在错误折叠的蛋白质中形成了不正确的二硫键而且不能被还原,蛋白质就会被冻结在错误构象而不能达到天然状态。如果这个二硫键得以还原,蛋白质就会继续在半折叠中间状态之间变化,直到形成正确结构。如果形成了正确的键, 它就可以稳定最终的天然蛋白质。即使偶尔被还原,蛋白质也会处于稳定状态,而且通过再氧化又能形成正确的
键 。因为这个原因,仅在溶解缓冲液中而不在重折叠缓冲液中加入还原剂, 常常也可以取得成功。重折叠后,可以使蛋白质经历缓慢的空气氧化(在空气中 暴 露 1〜2 天),常常能获 得正确的二硫键结构。关 于 更 多 的 再 氧 化 的 内 容 可 见 V allejo和 Rinas(2004)及Kirsten 和 Raines(2003)的文献。
形成二硫键的一些经典方法如下所述。
(1) 空气氧化 不 加 还 原 剂 暴 露 在 空 气 中 数 天 。
(2) 氧化还原缓冲液 如 还 原 型 谷 胱 甘 肽 (G S H )/氧化性谷胱甘肽(G S S G )(10/1,3 m m o l / L G S H /0. 3 m m o l / L G S S G )。有多种氧化还原对(redox pair) 在使用,它们包括还原型谷胱甘肽(G S H ) 和氧化型半胱氨酸、二硫苏糖醇 (D T T )和谷胱甘肽。为了取得最佳的二硫化物的再氧化效果,还原形式与氧化形式的摩尔比有时是不同的。
(3) 蛋白质二硫键异构酶(protein disulfide isomerase,P D I ) 该 酶 可 以 催 化 二 硫 化物 的 「洗 牌 」(Kersteen and Raines, 2003)。也 可 以 使 用 小 分 子 P D I 类 似 物(m i m i c s)(W o y c e c h o w s k y e t a l .,1999)。
7.鉴 定
在 浏 览 涉 及 重 折 叠 的 论 文 时 ,我 发 现 最 常 见 的 问 题 是 研 究 者 不 知 道 他 最 终 得 到 的 蛋白 质 是 否 进 行 了 正 确 的 折 叠 、是 否 是 单 分 散 性 的 (monodisperse) 以 及 是 否 具 有 完 整 的 生物 活 性 。常 见 的 方 法 是 酶 学 分 析 或 生 物 学 分 析 , 但 通 常 没 有 任 何 标 准 。你 可 以 见 到 诸 如「由 于 终 产 物 具 有 活 性 ,这 显 示 其 进 行 了 正 确 的 折 叠 而 且 具 有 完 整 的 活 性 」这 样 的 描 述 。然 而 只 有 与 已 知 的 、具 有 完 整 活 性 的 标 准 品 进 行 比 较 后 才 能 评 估 终 产 物 具 有 多 少 活 性 。没 有 比 较 ,你 只 能 知 道 其 有 活 性 ,但 无 法 确 定 活 性 蛋 白 质 的 百 分 比 是 1〇 〇 %、1〇 %、〇. 1 %还 是 0. 0 1 % 。如 果 可 能 的 话 , 对 重 折 叠 过 程 所 得 到 的 终 产 物 的 特 异 性 与 活 性 进 行 这 种 定 是 必 须 的 。
另 有 一 项 重 要 的 鉴 定 是 确 定 重 折 叠 蛋 白 质 的 大 小 。是 单 体 (单 分 散 性 )还 是 含 有 大 量可 溶 的 多 聚 体 [非 均 相 分 散 (heterodisperse)] 。 晶 体 学 家 通 常 使 用 动 态 光 散 射 (dynamiclight SCattering,D S L ) 来 确 定 纯 化 的 、重 折 叠 或 未 重 折 叠 的 蛋 白 质 是 否 是 单 分 散 性 的 。另一 个 方 法 是 由 加 利 福 尼 亚 州 L a Jolla市 的 诺 华 研 究 基 金 会 基 因 组 研 究 所(G enomicsInstitute of the Novartis Research Foundation,G N F )的 M a r k K n u t h 开 发 的 ,利 用 分 析 性分 子 筛 色 谱 技 术 (analytical size exclusion chromatography,A N S E C )分 析 终 产 物 。我们
发 现 该 方 法 非 常 有 用 ,因 为 即 使 非 常 少 量 的 蛋 白 质 也 能 用 该 法 分 析 。通 常 ,我 们 用 12 m L的 S h o d e x K W -802. 5 柱 子 和 含 有 0. 25 m o l / L N a C l 的 缓 冲 液 ,以 0. 5 〜 1. 0 m L / m i n 的流 速 分 析 20〜 5 0 ug 的 样 品 ,同 时 监 测 280 r n n 和 215 n m 的 紫 外 线 吸 收 。 当 柱 子 用 合 适的 分 子 质 量 标 准 进 行 校 准 后 ,就 可 以 快 速 地 确 定 大 部 分 蛋 白 质 是 否 处 在 所 预 测 大 小 的 单体 形 成 的 单 一 的 峰 内 (单 分 散 性 , 好 情 况),或 者 大 部 分 蛋 白 质 是 否 更 早 地 被 洗 脱 ,这 意 味着 多 聚 体 的 形 成 导 致 其 分 子 质 量 较 大 (非 均 相 分 散 ,糟 糕 的 情 况)。这 一 步 骤 的 分 析 是 一套 完 整 的 重 折 叠 测 试 实 验 的 重 要 组 成 部 分 (见 下 文 ) 。
不 能 用 圆 二 色 谱 (circular dichroism,C D )或 免 疫 印 迹 ( Western Blot)分 析 确 定 活 性或 单 分 散 性 。大 量 的 实 例 表 明 ,有 许 多 蛋 白 质 与 天 然 的 标 准 品 具 有 非 常 相 近 的 或 相 同 的C D 谱 ,而 且 在 免 疫 印 迹 分 析 中 结 果 很 好 ,但 其 实 不 具 备 单 分 散 性 或 者 不 具 有 活 性 。
三、蛋白质重折叠条件的筛选实验
1. 系统的重折叠筛选
在 前 面 所 述 的 常 规 流 程 以 及 讨 论 中 , 我 们 假 设 已 经 知 道 了 针 对 目 标 蛋 白 质 的 合 适 重折 叠 溶 液 。然 而 ,这 是 设 计 有 效 的 重 折 叠 方 案 时 最 不 可 缺 少 也 是 最 困 难 的 部 分 。在 早 期叙 述 的 蛋 白 质 重 折 叠 论 文 中 ,通 常 只 选 用 一 种 重 折 叠 溶 液 ,它 或 者 有 效 或 者 无 效 。那些 有效 的 就 发 表 出 来 ,而 无 效 的 则 通 常 舍 弃 。这 导 致 的 结 果 就 是 早 期 成 功 进 行 重 折 叠 的 蛋 白
质 是 那 些 通 常 在 许 多 不 同 的 条 件 下 都 能 很 容 易 地 重 折 叠 的 蛋 白 质 。近 年 来 ,人 们 越 来 越明 白 许 多 蛋 白 质 只 能 在 非 常 特 殊 的 条 件 下 才 能 重 折 叠 。挑 战 已 经 变 为 如 何 对 许 多 可 能 的条 件 进 行 筛 选 以 从 中 挑 选 出 能 有 效 地 促 进 蛋 白 质 重 折 叠 的 条 件 。最 重 要 的 一 个 进 展 是 使用 部 分 因 子 原 理 (fractional factorial approach)去 系 统 地 确 定 许 多 不 同 变 量 的 影 响 (A r m
strong et a L , 1999; C o wieson et al., 2006; Quronfleh et al., 2007; TTre saugues et al.,2004; Vincentelli et al.,2004;Willis et al., 2005)。
已 经 开 发 了 数 种 商 业 化 的 产 品 用 于 帮 助 研 究 者 鉴 定 合 适 的 蛋 白 质 重 折 叠 条 件 。关于蛋 白 质 重 折 叠 条 件 筛 选 和 相 关 操 作 方 案 的 更 多 信 息 可 参 考 下 面 的 公 司 网 站 。
A t h e n a E S QuickFold™ (15-solution kit), http://w w w .athenaes.c o m /QuickFoldProteinRefolding Kit;
EMD/Novagen, s iF0LDl™ 、 iF0LD2™ 和 iFOLD3™(96-solution kit), http:,//www. novagen. com;
Pierce Biotechnology’s ProMatrix™ ( 9 6 -solution kit c o m p o n e n t s ) , http://w w w .fishersci.c o m 。
随 着 这 种 筛 选 技 术 使 用 经 验 的 积 累 和 新 的 辅 助 方 法 的 鉴 定 , 这 个 名 单 很 可 能 会 变 长 ,筛 选 技 术 也 会 继 续 进 步 。必 须 注 意 的 是 , 对 于 那 些 买 不 起 这 些 昂 贵 试 剂 盒 的 研 究 者 来 说 ,没 有 什 么 可 以 阻 止 他 们 设 计 一 套 自 己 的 测 试 溶 液 及 制 订 自 己 的 蛋 白 质 重 折 叠 筛 选 方 法 以满 足 他 们 特 殊 的 需 求 ,这 里 的 关 键 是 系 统 的 平 行 筛 选 多 种 重 折 叠 条 件 。
2.重折叠中的变量
存 在 许 多 的 溶 液 变 量 (如 P H 、温 度 、盐 浓 度 、氧 化 还 原 环 境 和 二 价 离 子 的 存 在 )和添加 剂 (additive) (已 有 报 道 显 示 它 们 能 够 提 髙 溶 解 的 包 涵 体 蛋 白 的 重 折 叠 效 率 )。在 设 计前 面 提 到 的 商 业 化 蛋 白 质 重 折 叠 筛 选 产 品 时 已 经 考 虑 到 了 这 些 变 量 和 添 加 剂 ,它 们 也 为那 些 想 要 设 计 自 己 的 蛋 白 质 重 折 叠 筛 选 方 法 的 研 究 者 提 供 了 示 例 。下 面 讨 论 了 这 些 变量 。其 他 的 关 于 蛋 白 重 折 叠 的 综 述 对 其 中 一 些 变 量 有 更 详 细 的 讨 论 (A r m s t r o n g et a L ,1999; C o w i e s o n et al.> 2006; Middelberg; 2002; Quronfleh et al.> 2007; Schein> 1991;Singh and P a n d a , 2005; Tresaugues et al., 2004; Vallejo and Rin a s, 2004; Vincentelli
et a l , 2004; Willis et al., 2005)
(1) p H 大 部 分 蛋 白 质 重 折 叠 在 p H 5 〜 9 内 完 成 ,在 我 们 实 验 中 ,大 部 分 蛋 白 质 在p H 8〜 8. 5 时 重 折 叠 效 果 最 好 。 一 般 来 说 ,所 使 用 的 p H 距 蛋 白 质 等 电 点(蛋 白 质 不 带 净电 荷 ,最 倾 向 于 沉 淀 时 的 p H )至 少 相 差 一 个 单 位 是 个 不 错 的 想 法 。
(2) 温 度 目前,没有明显的趋势表明有任何广泛适用的最佳蛋白质重折叠温度。大部分研究者在接近 室 温 的条件下进行蛋白质重折叠。这个温度对于 防 止 蛋白质的热损伤足够低,对于增加分子的热力学运动又足够高, 分子的热运动对于溶解瞬时错误折叠构象和达到天然构象可能是非常重要的。有人也许会说更髙的温度会加强可能导致聚集的疏水相互作用,但它也会加强将疏水残基埋在天然构象内部时所需的疏水相互作用。
Xie和 Wetlaufer(1996)发表了一篇非常有趣的文章, 该文涉及在4 m g / m L 的蛋白质浓度下, I m o l / L G u H C l 和 50 m m o l / L Tris 硫酸 (Tris sulfate),p H 7. 5 的条件下,在不同温度下重折 叠 碳 酸酐 酶 IKcarbonic anhydrase II) 。其 结 果表明在低温(4〜 12°C)下重 折 叠 120 min, 然后温度「跳跃」(temperaturundefinedleap)至 36°C并 持 续 30 min,这样可以得到非常好的酶活回收率(>9 〇 %)。他们认为在低温下疏水相互作用会被减小,从而尽可能的降低了聚集作用,同时允许蛋白质缓慢的转变为一种无活性的或无聚集倾向的中间体 。当温度从 4°C「跳跃」至 36°C 时,这种中间体就会转化为有高活性的天然形式。
(3) 盐 浓 度 可 能 需 要 某 些 盐 来 起 到 「盐 溶 』』 (salting in) 作 用 以 增 加 天 然 蛋 白 质 的 可溶 性 (见 本 书 第 20 章)。 通 常 使 用 50〜 100 m m ol/L 的 盐 。在 对 6 m ol/L 盐 酸 狐 稀 释 60倍 时 ,盐 酸 胍 的 终 浓 度 就 变 为 〇. I m ol/L。 为 了 不 影 响 与 合 适 的 离 子 交 换 层 析 柱 的 结 合 ,通 常 避 免 加 入 其 他 盐 以 使 盐 浓 度 就 保 持 在 足 够 低 的 水 平 。
(4) 氧 化 还 原 试 剂 前面关于再氧化的章节已经讨论了使用氧化还原缓冲液辅助二硫键的形成。在一些商业化试剂盒中,包含有无还原剂溶液、有还原剂溶液,以及含有不同比例的还原剂和氧化剂的氧化还原缓冲液。
(5) 二价阳离子 该 变 量 还 未 经 过 全 面 的 探 索 研 究 ,但已知天然蛋白质通常含有二价阳离子(如 M g 2+ 或 Z n 2+ ) 作为其结构的一部分。显 然 ,任何能够稳定蛋白质天然结构的因素都会利于重折叠向天然构象的方向进行,而远离蛋白质的聚集。
(6) 精 氨 酸 和 其 他 氨 基 酸 有 大 量 的 文 献 描 述 了 使 用 精 氨 酸 (arginine) 来 促 进 溶 解蛋 白 的 重 折 叠 ,以 及 解 释 其 如 何 减 弱 了 聚 集 作 用(A r a k a w a et al.,2007; Baynes et al.,2005; D a s et al.,2007; D o n g et al.,2004; R e d d y et al.,20 〇 5) 。似 乎 精 氨 酸 可 以 通 过 降低 蛋 白 质 间 相 互 作 用 的 速 率 来 减 弱 聚 集 作 用 。 D a s 等 认 为 这 是 由 于 精 氨 酸 在 溶 液 中 形 成了 超 分 子 组 装 体 (supramolecular assembly) 。其 缺 点 之 一 是 通 常 在 0. 5 〜 1. 0 m o l /L 浓度 下 使 用 ,这 也 是 其 最 有 效 的 范 围 。如 果 不 经 稀 释 或 透 析 ,此 浓 度 就 会 妨 碍 后 续 的 Ni2+ 螯合 亲 和 层 析 柱 色 谱 ,并 会 阻 止 大 部 分 蛋 白 质 与 离 子 交 换 层 析 柱 的 结 合 。已 经 发 现 天 然 的 渗
透 保 护 剂 (osmoprotectant) 脯氨酸有时无论在体夕卜还是体内也能增强蛋白质可溶性。
(7) 甘 油和糖 [ 蔗 糖 、甘露糖醇(mannitol)、山梨糖醇(sorbitol) 和 海 藻 糖 (trehalose)]我 们 已 经 发 现 在 许 多 时 候 甘 油 都 是 非 常 好 的 蛋 白 质 重 折 叠 添 加 剂 ,通 常 的 使 用 浓 度 为5 % 〜 3 0 % 。 S h i m a m o t o 等 (1998) 使 用 的 一 个 极 端 的 方 法 涉 及 将 包 涵 体 用 6 m o l /L 盐 酸胍 溶 解 至 2〜10 m g /m L ,加 入 甘 油 至 5 0 % (V /V ) ,在 7 5 % 甘 油 中 透 析 以 除 去 变 性 剂 , 然后 快 速 稀 释 至 5 % 〜 1 0 % 的 低 甘 油 浓 度 。 已 经 发 现 一 些 糖 为 〇. 5 〜 I.5 m o l /L 时 能 成 功地 促 进 蛋 白 质 重 折 叠 ( B o w d e n and Georgiou, 1988)。
(8) 其 他 化 学 添 加 剂 大量的各种各样的论文报道使用诸如聚乙二醇(polyethyleneglycol,PEG ) (Cleland et al., 1992)、环糊精(cyclodextrin) (Rozema and Gellm an, 1996),以及各种非去污剂横酸甜菜喊(nondetergent sulfobetaine,NDSB) (Expert-Bezancon etal., 2 0 0 3 ) 这样的物质来促进特定蛋白质的重折叠。有报道称特定的离子液体(i 〇 nic liquid) (如熔点低于 100°C 有机盐), 例 如 ,A T -烷 基 N - 甲 基咪唑氯化物 (N’-alkyl-N -m ethylimidazolium chloride)可作为重折叠添加剂(Lange et al., 2005)。乙基(e th y l)和丙基衍生物 (propyl derivative)在 0•5 〜 I. 0 m ol/L 的 浓 度 下 表 现 出 了 与 左 旋 精 氨 酸 (L-arginine) 相当的增加蛋白质活性和重折叠产量的作用。
(9) 去 污 剂 理论上, 去污剂在重折叠时应该可以帮助阻止聚集作用。在低浓度下,它们与暴露的疏水区或黏性区微弱结合,并将其掩盖,从而阻止聚集作用。当它们的浓度降低时,就会从蛋白质解离从而允许蛋白质天然构象的形成。这被认为是十二烷基肌氨酸钠能够很好地起作用的原因。在高浓度下,其为变性剂,在低浓度下其就作为人工分子伴 侣 ,阻止了聚集作用从而促进重折叠。
(10) 离液剂(chaotropic a g e n t)( 高浓度下 的 变 性 剂)由 于 聚 集 作 用 是 由 部 分 折 叠的 中 间 体 之 间 的 相 互 作 用 导 致 的 , 有 时 在 重 折 叠 溶 液 中 加 人 非 变 性 剂 量 的 离 液 剂(chaotrope) 对 解 离 聚 集 体 是 有 用 的 ,同 时 不 会 损 伤 更 稳 定 的 天 然 结 构 。常 用 I m 〇 l/L 尿 素 和
0.5 m o l /L 盐 酸 胍 。
(11) 目 标 蛋 白 质 特 异 的 添 加 剂 如 同 前 面 关 于 特 定 二 价 阳 离 子 的 潜 在 好 处 的 论 据一 样 ,诸 如 合 适 的 底 物 、辅 因 子 (cofactor) 、或 必 需 的 血 红 素 基 团 ( h e m e gro u p) 等 物 质 的 存在 可 以 稳 定 目 标 蛋 白 质 天 然 结 构 , 提 高 其 重 折 叠 产 量 。
3. 一个实用的、经济的、合理的方法
有了所有的重折叠筛选方法,你还必须获得某种读出(readout)来显示哪种条件最有效 。最好的情况是你的目标蛋白质是已知的酶,且很容易分析。你只需将你溶解的蛋白质稀释至不同的重折叠缓冲液中, 等待一些时间以完成重折叠(通常为数小时),然后取一部分稀释的溶液分析其酶活性。
如果你想检测各种条件对重折叠 GFP 这样的荧光蛋白的影响就更简单了,因为只有当 GFP 折叠正确时荧光才能恢复,而且在折叠中和折叠后也很容易通过合适的荧光平板读取器进行测量。这给蛋白质重折叠的教学提供了非常好的训练方法,并且已被用于冷泉港的蛋白质培训课程中(R .Burgess、N. T h o m p s o n 、R . C h u m a n o v ,未发表的结果)。
然而,近来研究的大部分蛋白质既不是酶,也没有简单的生物学分析方法。如何知道哪种重折叠条件效果最好呢,下面的操作方案已经被使用并取得了巨大成功的 (R. C h u -m a n o v 和 R. Burgess, 未发表的结果)。 该操作流程相当普通, 利用了蛋白质聚集导致的溶液的浑独(Tre’saugues et al., 2004; Vincentelli et al., 2004)。
(1) 准备洗涤过的包涵体,溶解于前面提到的几种不同的离液剂中, 并离心除去不溶物 。蛋白质浓度应当为3〜5 m g /m L 。
(2) 根据你认为可能起作用的变量和添加剂,准备一套待测溶液。
(3) 用移液器吸取 10 uL 溶解的蛋白质,将 其 移 人 9 6 孔微量滴定板(Linbro, 平 底 ,聚苯乙烯)的合适数目的孔中。
(4) 加 人 190 uL 待测的重折叠溶液, 在室温下用移液器上下混匀数次以进行 2 0 倍的瞬间稀释。
(5) 等 待 15〜60 min, 读 取 320 nm 的吸光度。溶液是不吸收光的,但蛋白质聚集物会散射光从而降低测量到的透射光的量。这种方法效果很好,因为波长越短,光的散射越强 ,蛋白质在320 nm 没有吸收,而320nm 又是我们可以使用的最短波长,因为平板会对更短的波长有很大的吸收。在 320 nm 塑料导致的空白孔的吸光度大约为0.2 , 可以用溶液浑浊导致的表观吸光度读数减去该值以得到校正的浊度。
(6) 可以使用减去平板吸光度后得到的吸光度数值对溶液编号作图, 这样可以看出哪种溶液的浊度最低。校正后的浊度值一般为 0 .0 〜0 .4 。 我们常常发现多种条件都可以得到低的甚至是为零的校正浊度。使用不同的溶解试剂, 如6 m ol/L 盐酸胍、8 mol/L尿 素 或 〇• 3% 十二烷基肌氨酸钠将蛋白质变性通常会得到稍有不同的结 果 。
(7) 选 择 2 种 或 3 种可以直接上样 (经过过滤)至分析性分子筛色谱柱(A N S E C ,见本 章 5. 7 节)的最好条件。为了在大规模重折叠中真正有用,其同时还必须能够直接上样至合适的离子交换层析柱,其盐浓度应约为 0. I m o l / L N a C U 将溶液(约 200uL ) 从相应的孔中取出,用注射器式滤器过滤或用微量离心管离心, 上样至12 m L 的 A N S E C 层析柱 。一个能够得到低浊度和经 A N S E C 层析柱分析大部分为单体的条件就是可能用于目标蛋白质大规模重折叠的条件。
来源:丁香实验