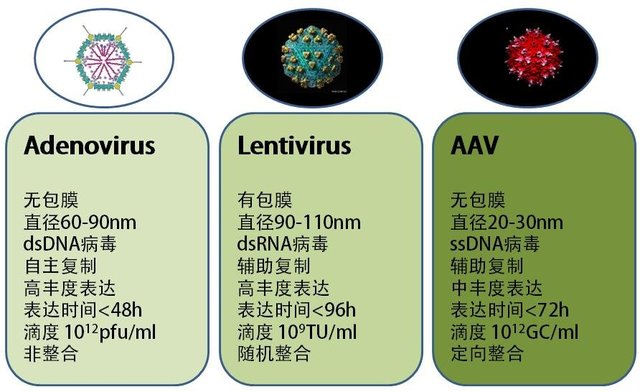
腺相关病毒载体(AAV)
互联网
摘要: 腺相关病毒(AAV)是一种人细小病毒,目前因为能作为一种基因治疗载体而受到广泛关注。构建重组AAV(rAAV)涉及到用一个目的基因替换病毒基因组的大部分,然后将这个重组基因组包装到一个有感染性的病毒颗粒里。
目前大多数生成rAAV的实验方案需要共转染一个载体质粒和一个表达病毒复制和结构基因的包装质粒到腺病毒(Ad)感染的培养细胞中。此方法的局限性包括(1) Ad辅助病毒污染rAAV,(2)rAAV的低产出,(3)生成有复制能力的AAV。在此报道中我们描述了新的辅助质粒(pH3和pH5),排除了Ad共转染的需求。
辅助质粒表达AAV的rep和cap基因和Ad E2A、VAI和E4基因。当辅助质粒在没有Ad感染的情况下共转染到人293细胞中,rAAV载体产量超过了pAAV/Ad包装质粒的80倍。另外,有复制能力的AAV在rAAV制备过程中少于0.00125%。
此系统的主要优点是(1)无需感染性的腺病毒(2)只使用两个质粒就提高了转染效率和载体的产出。我们相信该双质粒转染系统因其简便性和高产出而使AAV载体系统能被更广泛地使用。该系统尤其将对多rAAV载体的临床前分析有用。
1.简介
腺相关病毒(AAV)是一个常见的人细小病毒,自然缺陷、无包被和无致病原性。AAV复制周期由两个明显的阶段构成:潜伏期和增殖期。在缺少辅助病毒诸如腺病毒(Berns,1990;Muzyczka,1992;Berns和Giraud,1996)、疱疹病毒、牛痘病毒或者在基因毒条件下(Yakobson等,1989),AAV能复制产生子代病毒颗粒。
在缺少辅助病毒的情况下,腺相关病毒整合其基因组到19号染色体的一个特别位点并保持整合直到随后的辅助病毒将其从潜伏状态下拯救出来(Kotin等,1990)。AAV的位点特异性的整合能力、其自然缺陷以及其无致病原性使其成为基因治疗载体成为可能。
重组AAV(rAAV)载体能转导培养细胞以及体内不同组织比如肺(Flotte等,1993;Conrad等,1996;Halbert等,1997)、脑(Kaplitt等,1994)、肌肉(Xiao等,1996)、视网膜(Ali,1996;Flannery等1997)、中枢神经系统(Peel等,1997)和肝(Xiao等,1998)。
AAV基因组是一个线性、单链(ssDNA)分子,4680个核苷酸,在每个末端含有一个145个碱基末端重复序列(TR)(Srivastava等,1983)。TR序列折叠成发卡结构作为DNA复制起始和包装重组AAV基因组为感染性的病毒颗粒所需的唯一已知顺式作用元件。
TR元件位于两个翻译开放阅读框(ORF)的两侧。左侧ORF(或rep基因)编码四个非结构蛋白质称为Rep78、68、52和40,对于病毒DNA复制和包装是关键性的。右侧的ORF(或cap基因)编码三个结构蛋白质VP1、VP2和VP3(Berns,1990;Muzyczka,1992;Berns和Giraud,1996)。
重组腺病毒载体(rAAV)的构建通常涉及rep和cap基因的剔除和将感兴趣的转基因插入TR元件之间。产生的载体质粒随后与一个表达AAV的rep和cap基因的包装质粒一起共转染到组织培养细胞中。质粒转染的组织培养细胞被感染Ad以提供辅助功能以有效复制AAV和基因表达。
几天后收获培养物,并利用柱层析或多轮超速离心纯化rAAV。60°C加热灭活任何残留的Ad。关键的Ad辅助基因包括:E1a转录激活Ad以及AAV基因,E1b和E4编码增进mRNA装运到细胞质的蛋白质,E2a表达一个ssDNA结合蛋白质促进AAV DNA复制,VAI RNA基因生成一个小RNA转录物增进AAV capsid mRNA的翻译。
此繁琐过程的局限性阻止了rAAV广泛发展为基因治疗的载体。如上所述载体的生成总是导致载体的明显Ad污染,因此需要热处理和严格的纯化方法灭活和去除Ad病毒颗粒污染。尽管载体和包装质粒之间通常没有同源序列,但是经常产生野生型样有复制能力的AAV(rcAAV)(Allen等,1997;Wang等,1998)。
已经进行了许多尝试改进rAAV载体的包装效率。它们包括:发展表达一些或所有包装所需的AAV基因的细胞系(Yang等,1994;Clark等,1995;Tamayose等,1996;Inoue和Russell,198),构建Ad辅助质粒能够用来替代Ad感染(Matsundefined*a等,1998;Xiao等,1998b)和发展重组Ad携带rAAV载体基因组(Gao等,1998)。
我们已经构建了新的辅助质粒,完全不用在rAAV包装过程中感染Ad。这些质粒含有Ad基因组的VA、E2a和E4基因以及AAV的rep和cap基因。当转染到含有Ad5E1a和E1b基因的人293细胞中,辅助质粒提供了一个有效的、无Ad污染的包装系统。
我们用此新系统所产生的rAAV滴度与大多pAAV/Ad包装质粒(Samulski等,1989)相比提高了80倍。另外,Ad再也不能产生,有复制能力的AAV在任何载体制备过程中尚未发现。
2.材料和方法
2.1. 质粒、细胞和病毒
一个rAAV载体质粒,表达人绿色荧光蛋白的pTR-UF5(Peel等,1997)被用到所有包装实验中来优化该系统。这个pAVbgal载体质粒含有AAV TR,位于巨细胞病毒(CMV)早期转录启动子和E.coli b半乳糖苷酶基因的两侧。
PAAV/Ad质粒被用来作为一个包装质粒与辅助质粒进行比较(Samulski等,1989)。pCDMrep质粒含有AAVrep基因,受CMV早期启动子的调控(Yang和Trempe,1993)。
19193bp的辅助质粒,pSH3和pSH5可以通过几个步骤来构建。一个1.5kb含有VAI和VAII基因的HindIII到SalI的片段(来自Ad5的nt9831-11555)被插入到pGEM3Z的同一位点产生pVA3。将一个5.8kb含有E2a基因的BamHI和EcoRI的片段(来自Ad的nt21563-27331)插入到pVA3的同样位点中产生pVA3E2a。
来自pSub201的4.3kb XbaI片段(AAV2中的nt177-4471),包含AAV rep和cap基因,随后被插入到pVAE2aE4的两个XbaI位点。其中一个pVAE2aE4上的XbaI位点位于E2a和VAI和II基因片段,另外一个位点(在Ad2基因组的nt10580)在VAI基因的上游被发现。两个版本的辅助质粒(pSH3和pSH5)区别在于4.3kb XbaI插入片段的方向,并在Fig.1B显示。
pSH3和pSH5辅助质粒保存在E.coli的HB101株中。质粒从500ml的细菌培养物中纯化出来,其分为4´125m,每个部分用Qiagen Plasmid Maxi 试剂 盒的方法处理。 人293(Ad-5转化胎肾上皮)细胞和Hela细胞在补充有10%胎牛血清和抗体的EMEM中培养。细胞在37°C、5%CO2的单层培养基中培养。