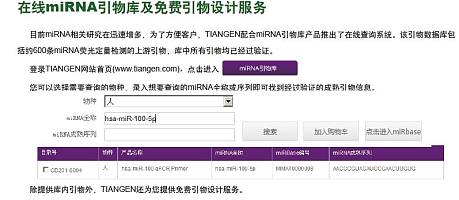
miRNA检测
互联网
28634
一、miRNA简介
小 RNA是 19~28 nt 的调控RNA分子,主要包括微 RNA(micro RNA,miRNA)和小干涉RNA(short interfering RNA,siRNA)两类,其中的miRNAs成为继 siRNAs之后新的研究热点之一,名列2002年和2003年美国《科学》杂志评出的年度十大科学成就。
miRNAs是长片段RNA序列的一部分,同siRNAs一样是比较短小的单链小分子RNA,一般来源于染色体的非编码区域,由大约70 nt大小的可形成发夹结构的前体加工而来,它通过与其目标mRNA分子的3 端非编码区域(3-untranslated region,3 UTR)互补导致该mRNA分子的翻译受到抑制。
MiRNA检测方法
要了解miRNA在基因调控中扮演的角色,很关键的一个方法就是迅速、准确地定量检测miRNA基因的表达。因此,miRNA表达水平的检测也成为了科学家们研究的热点。但是由于小分子RNA是一类很小的分子,部分小分子RNA表达水平可能很低,因而需要极为灵敏而定量的分析工具。常用的检测方法有:
1. Northern blotting
2. 核糖核酸酶保护分析以及基于此方法的液相杂交。
3. RT-PCR也被用来检测miRNA前体的表达水平, 其他基于PCR技术检测miRNA的方法有
引物延伸法,就是在引物的5 末端加一个特异标记,可以定量测定低丰度的RNA含量;
原位杂交技术(CISH,FISH)可以方便的检测miRNA的时空表达的差异。
4. 芯片(microarrays)技术[46,47]是一种较快的研究miRNA表达的方法。
二、反转录引物分类以及设计原理
Real-time PCR方法克服了由于miRNA分子太短(~22 nt)带来的定量最大难题而引入靶向特异性的反转录引物,该RT引物可以与成熟miRNA结合,形成反转录引物/成熟miRNA复合物,并在miRNA的5’末端延伸。这样就得到一个较长的反转录扩增因子,为进一步做实时定量PCR提供了符合要求的摸板。
RT引物有两种类型:
1. Oligod(T)特异的RT引物(QIAGEN产品为主)
由特异序列+(T)20左右+兼并碱基V或VN组成。(所有miRNA可以公用一个Oligod(T)的RT引物,但是RNA在反转录前需要进行末端Poly(A)加尾)
2. 茎环状结构的RT引物(ABI产品为主)
由可以自身呈环茎状的特异序列+6到8个miRNA3’端反向互补碱基组成。(一条miRNA序列特异对应一个茎环状结构的RT引物)
三、引物探针设计
由于反转录后得到的cDNA 为(miRNA+RT引物)复合片段。
上游引物可以在miRNA自身序列上找,如果GC含量太低,可以在上游引物5’端加入GCGCC等的保护碱基;下游引物在RT引物的反向互补序列中找;也就是说:上游引物是每个miRNA所特有的,下游引物为通用引物就可以了。
荧光定量PCR检测方法有SYBR Green染料法和TaqMan探针法。前者需要调整引物浓度以及引物扩增效率,把引物二聚体调整到越小越好;探针法则需要设计荧光探针,这其中由于MGB探针需要碱基数量少和特异性好的特点而被推荐。
探针设计位置有3个:完全与miRNA序列相同、在miRNA与RT引物的交叉点、完全在RT引物上;这其中又有正向和反向互补两种情况。至于探针要设计在那个位置,根据自己试验情况而定,本人以为效果都差不多。
四、试验操作流程
1. RNA提取
在以上两种RT引物中,Ologod(T)特异引物所需要的RNA尽量是用特殊试剂盒提取的小RNA,而茎环状结构RT引物需要RNA正常提取就好。
另外由于所需样本不同RNA提取方法也不完全相同,普通组织样本和细胞可以研磨用Trizol+氯仿抽提;血液和植物样本需要前期处理后再用Trizol+氯仿或用专门的Kit抽提。
2. 反转录
确认用Oligod(T)特异RT引物时,RNA需要进行3'Poly(A)加尾处理。
反转录的酶没有特殊要求,操作请按照各自反转录酶的说明书进行就好。这里特别注意的是:反转录过程中用到的RT引物(常规的是随机引物、Oligod(T)和特异引物)是前面提到的Ologod(T)特异引物和茎环状结构RT引物,它们分别属于Oligod(T)和特异引物范畴,在反转录中不需要另外添加其他RT引物。
在确定反转录温度中请特别注意您使用的是哪一种RT引物,而设定相应的反转录温度。
3. 荧光定量PCR
优化PCR体系(引物浓度、Mg浓度、dNTP浓度、退火温度等),正常操作。