Mol Cell:秦骏等发现结直肠癌患者分型标志物,他汀类药物或可治疗这类癌症
丁香学术
97
胆固醇和脂质合成速率上调被认为是癌症转化过程中的一种特殊代谢重组现象。胆固醇是细胞膜的重要生物成分,是胆汁酸和类固醇激素生物合成的前体。此外,胆固醇相关代谢产物作为信号分子发挥调节作用。虽然有关胆固醇与结直肠癌(CRC)风险的流行病学证据仍然没有定论,但实验模型的结果表明两者之间存在因果关系。
甲羟戊酸途径与肿瘤进展相关,其中的关键酶受甾醇调节元件结合蛋白(SREBP)家族转录因子的控制。然而,甲羟戊酸通路抑制剂(他汀类药物)只在部分患者体内发挥效用。因此,开发患者分层的生物标志物将有助于他汀类药物在抗癌治疗中的应用。
2021 年 4 月 30 日,来自中科院上海营养所和复旦大学的研究团队在 Molecular Cell 在线发表了题为 The ZMYND8-regulated mevalonate pathway endows YAP-high intestinal cancer with metabolic vulnerability 的文章。
该研究报道了一种结直肠癌患者分型的新型生物标志物 —YAP。这种生物标志物依赖于 ZMYND8 调节的甲羟戊酸通路。因此,他汀类药物可能对 YAP 高活性的肿瘤患者起效。

图片来源:ScienceDirect 截图
上海营养所秦骏、肖意传与复旦大学彭俊杰共为共同通讯作者。
研究内容:
ZMYND8 在肠道类器官和大肠癌中的功能鉴定
肠上皮细胞受到抑制肠上皮不断自我更新,来自增生隐窝区的细胞向上迁移、分化,并在大约 5 天内从绒毛尖端丢失。这种高周转率是由一个快速循环的肠干细胞(ISCs)池维持的,这些干细胞位于以 Lgr5 高表达为特征的隐窝底部。因此,Lgr5+ISC 功能障碍可导致再生缺陷或大肠癌的发生。ISCs 旺盛的自我更新能力要求足够的脂质和胆固醇供应。过量饮食胆固醇或细胞内胆固醇合成增强加速小鼠肿瘤的发生。
ZMYND8 作为表观遗传读取器发挥作用,在不同的细胞和遗传环境中促进或抑制肿瘤进展。在这里,研究人员发现 YAP 高肿瘤依赖于 ZMYND8 调节的 MVA 通路。因此,他们对他汀类药物治疗敏感。
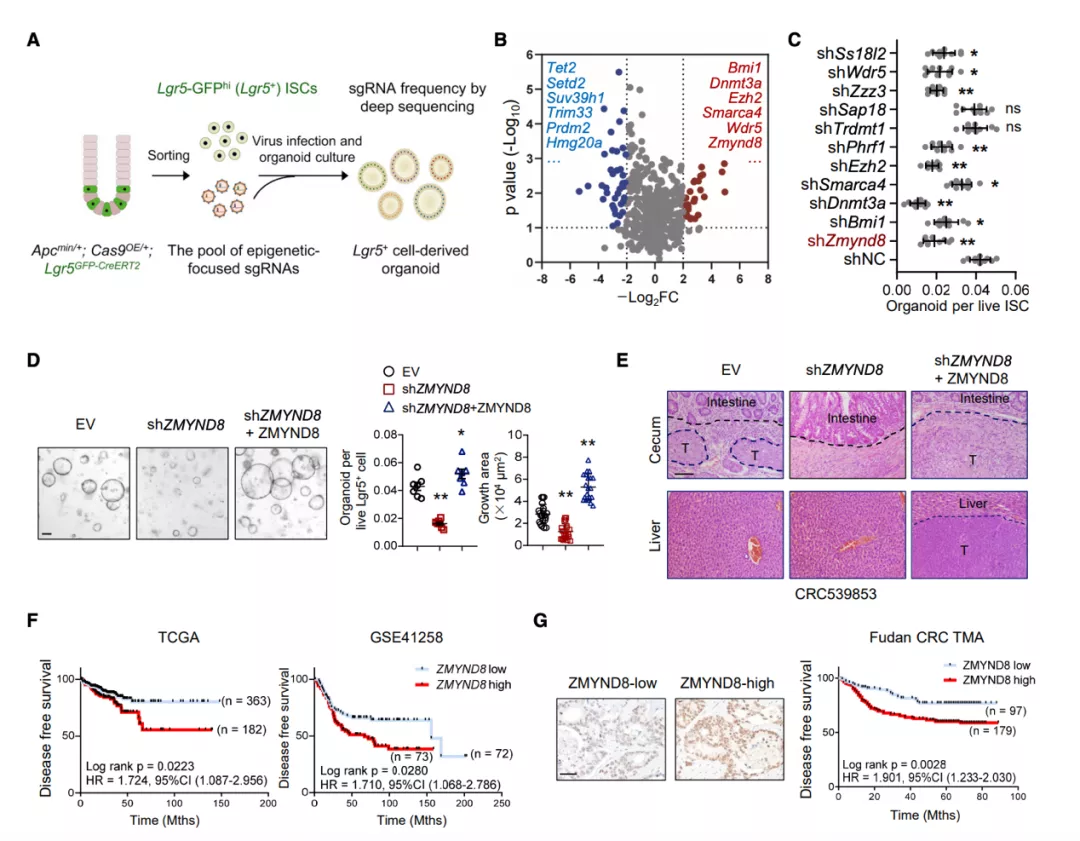
图片来源:Mol Cell
Lgr5+ISC 来源的类器官类似哺乳动物肠道的上皮结构。利用这个类器官平台,研究团队对 441 个表观遗传调控因子进行了 CRISPR-Cas9 筛选,以确定结直肠癌进展的决定因素,证实了切除 ZMYND8、Ezh2、Dnmt3a 和其他基因,消除了 Lgr5+ 细胞形成类肠器官的能力。
接下来,研究团队构建了缺失或过度表达 ZMYND8 的小鼠来评估 ZMYND8 在 CRC 中的功能,发现 ZMYND8 敲除减弱了 Lgr5+ 细胞产生类器官的能力,而 ZMYND8 过表达不仅逆转了这一缺陷,而且大大加快了类器官的产生。随后,研究团队将类器官植入小鼠的盲肠末端,发现 ZMYND8 的异位表达大大加重了肿瘤的恶性程度,60% 的小鼠在肝脏出现转移灶。总的来说,该结果表明 ZMYND8 促进 CRC 发生发展。
ZMYND8 为小鼠肠道再生和肿瘤发生所必需
为了探索 ZMYND8 在体内的功能,研究团队检测了 ZMYND8 在小鼠和人类肠道中的表达,发现 ZMYND8 蛋白存在于 Lgr5 GFP+ISCs 和 CD44 + 祖细胞中,但不存在于 Paneth 细胞中。通过基因打靶 ZMYND8 敲除(ZMYND8IEC–/–)小鼠,并采用全身辐射诱导再生模型评估 ZMYND8 的作用,发现 ZMYND8 敲除导致 ISCs 和祖细胞的比例降低,而 ZMYND8 的恢复增强了类器官的干细胞。接下来,研究团队产生了 Apcmin/+;ZMYND8IEC–/–小鼠,一系列分析表明 ZMYND8 缺失抑制 Apcmin/+ 小鼠腺瘤的发展。
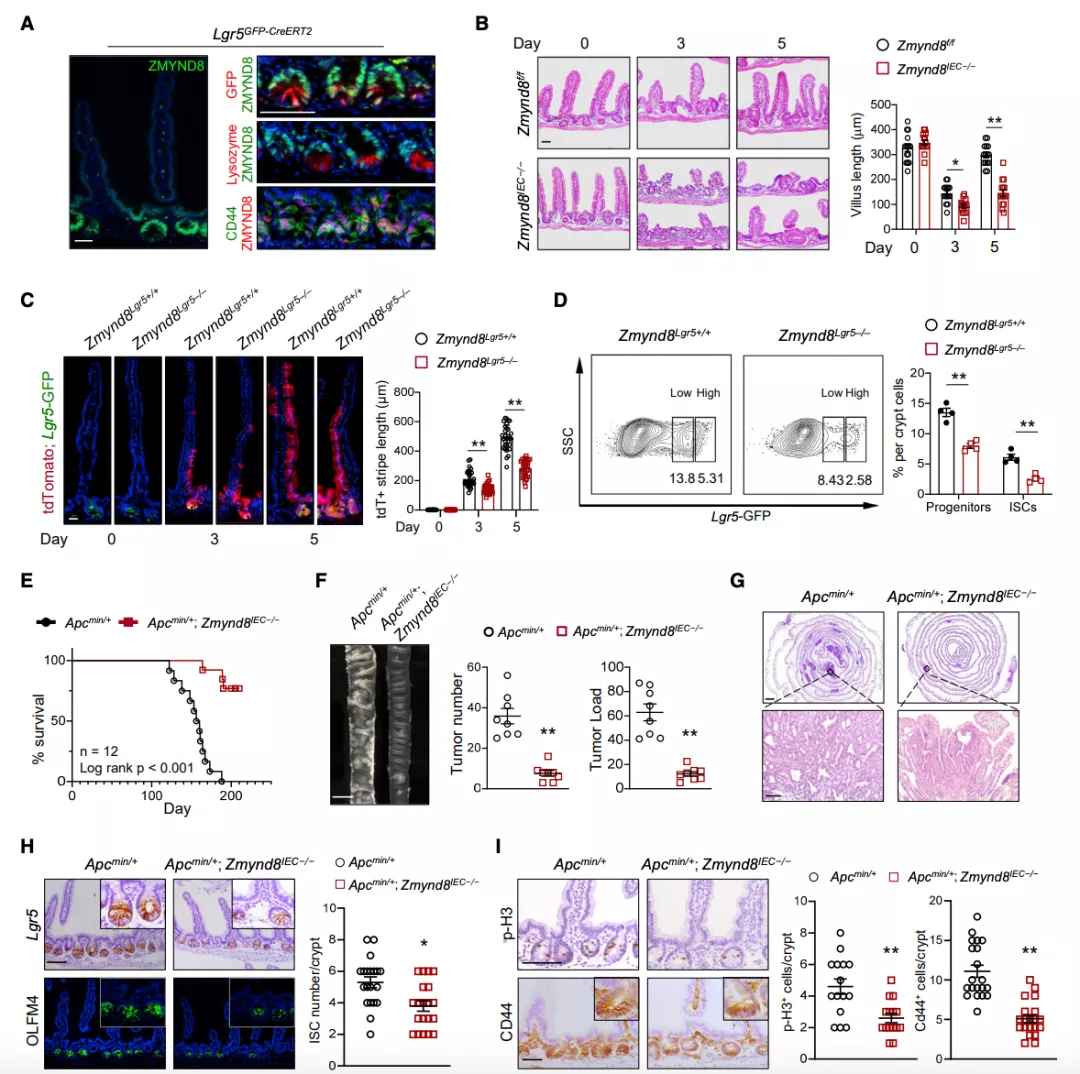
图片来源:Mol Cell
ZMYND8 通过调节甲羟戊酸途径驱动肠道干细胞和肿瘤的发生
为了探讨 ZMYND8 影响肠道干细胞和肿瘤发生的机制,研究团队分析了 2 个月大小鼠隐窝中的基因表达。基因本体论和途径分析显示,参与甾醇代谢过程和 SREBP2 途径的基因组因为 ZMYND8 的缺失而发生了最显著的改变,甲羟戊酸(MVA)途径中的大多数关键酶也下调了表达。因此,研究团队探究了 ZMYND8 是否调控 MVA 通路。qRT-PCR、代谢组学、Filipin 染色、类有机物中 13C 标记的醋酸盐示踪等实验表明,ZMYND8 丢失减弱了从头脂肪生成和胆固醇生物合成,表明 ZMYND8 调控 MVA 通路。
接下来研究团队研究了胆固醇生物合成的减少是否是 ZMYND8 致瘤功能的基础。将 Lgr5+ 细胞来源的类有机物与环糊精 - 胆固醇复合物一起培养,补充 ZMYND8 缺陷细胞中的胆固醇完全恢复了类器官的生成。相反,他汀阻断了胆固醇生物合成抑制类器官形成。小鼠实验中,维持西方饮食的 Apcmin/+ 小鼠表现出极大的加速肿瘤进展,而 ZMYND8 缺失小鼠的肿瘤潜伏期大大加快,达到与 Apcmin/+ 小鼠相似的水平,同时 OLFM4+ISCs 和 Ki67+ 细胞扩张。这些结果表明 ZMYND8 缺失导致下游胆固醇生物生成不足,限制肠道肿瘤的发生。

图片来源:Mol Cell
ZMYND8 与 SREBP2 相互作用调控甲羟戊酸通路
SREBP2 选择性地驱动甾醇生物合成途径中几乎所有关键酶。通过将 HCT116 细胞与脂蛋白缺乏血清(LPDS)培养基一起培养以激活 SREBP2 的实验,研究团队观察到 SREBP2 和 ZMYND8 之间发生相互作用,25 - 羟基胆固醇(25-HC)会消除这种相互作用,表明 MVA 途径的相互作用依赖性激活。接下来,研究团队进行了染色质免疫沉淀(ChIP)测序(ChIP-seq),分析结果强调了 ZMYND8 和 SREBP2 在上调 MVA 通路中的功能协同作用。
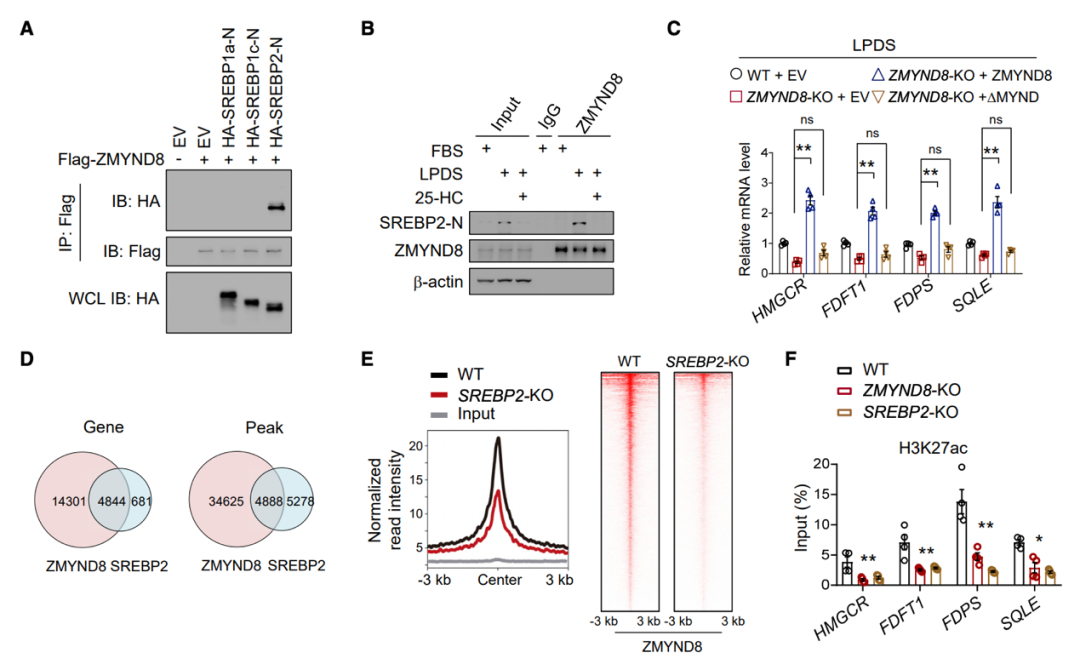
图片来源:Mol Cell
ZMYND8-SREBP2 驱动增强子 - 启动子相互作用刺激甲羟戊酸通路
对 MVA 途径基因座上的 ZMYND8 和 SREBP2 峰的分析表明,SREBP2 优先在启动子区域招募,而 ZMYND8 占据了 H3K4me1 和 H3K27ac 修饰标记的增强子和启动子区域。接下来研究团队选择 HMGCR、SQLE 和 FDFT1 作为模型基因,并进行染色体构象捕获(3C)分析以检测增强子和启动子是否在物理上接近。研究团队观察到 HMGCR、SQLE 和 FDFT1 基因的明显增强子 - 启动子相互作用,而 SREBP2 或 ZMYND8 KO 消除了接触。一系列分析结果表明 SREBP2/ZMYND8 与介体复合物结合以刺激 MVA 途径。
图片来源:Mol Cell
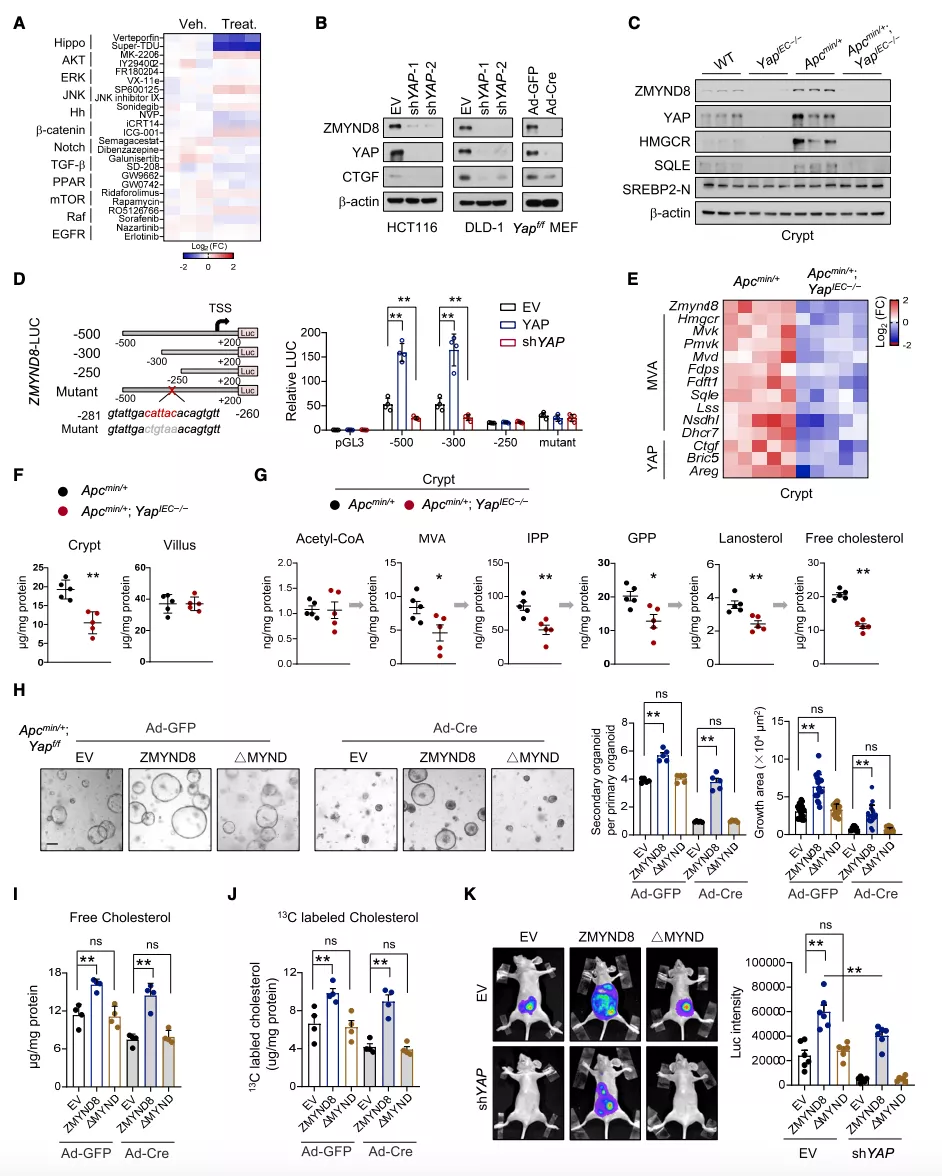
YAP 通过直接调节 ZMYND8 的表达增强肠道胆固醇的生物合成
为了确定控制 ZMYND8 表达的上游信号可能影响胆固醇的生物发生,研究团队在 HCT116 细胞中使用一组靶向各种信号的化合物进行筛选,发现 ZMYND8 作为 YAP 的下游感知环境或致癌损伤。接下来研究团队研究了 YAP 是否也影响 MVA 通路。通过 YAP 敲除和过表达小鼠,证实 YAP 通过调节 ZMYND8 的表达促进 MVA 通路。
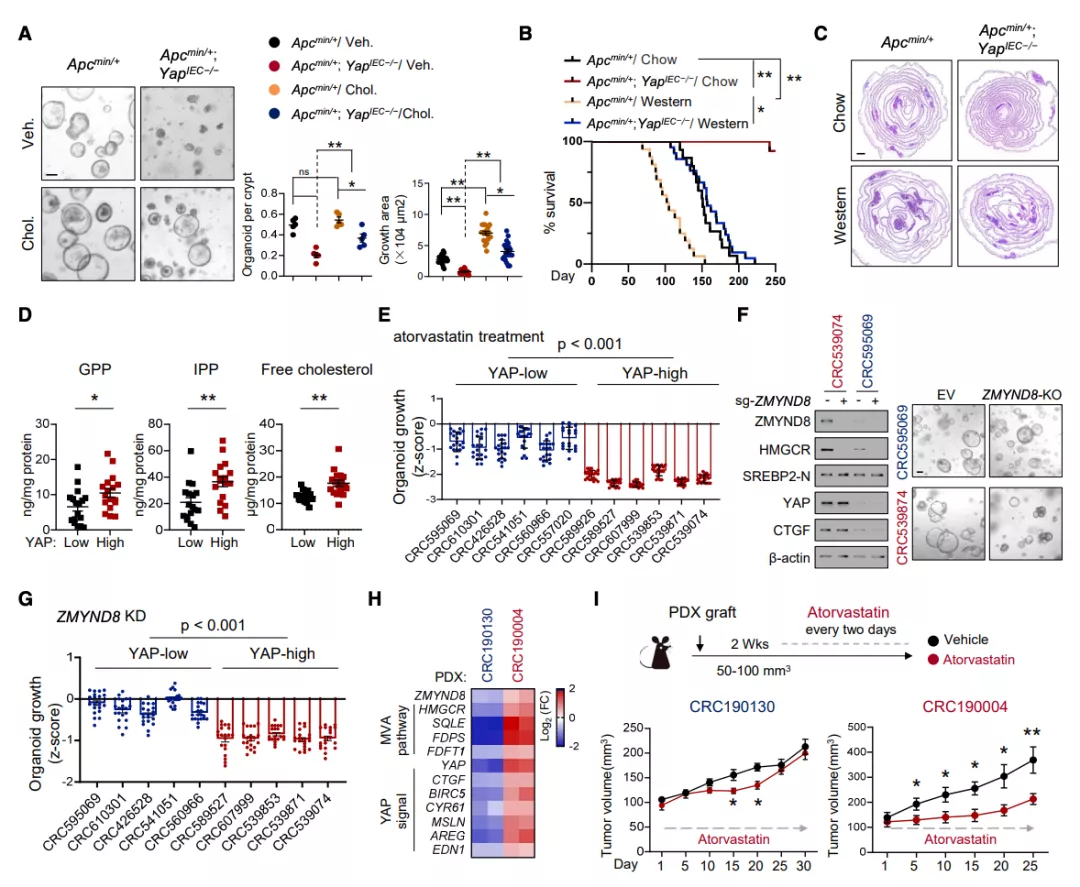
图片来源:Mol Cell
YAP 通过 ZMYND8 介导的甲羟戊酸途径促进肠道肿瘤的发生
为了评估 YAP 调节 MVA 通路的临床意义,研究团队首先研究了 YAP 与大肠癌 MVA 活性之间的关系,显示 YAP 信号与肿瘤中 ZMYND8 水平和 MVA 相关基因表达呈正相关。靶向代谢分析显示,YAP 高阳性的肿瘤产生的游离胆固醇、GPP 和 IPP 明显多于 YAP 低阳性的肿瘤。因此,研究团队提出了 YAP 高阳性肿瘤可能更依赖 MVA 通路的假说。对患者来源的 YAP 类有机物的分析显示,YAP 高类有机物对 ZMYND8 缺失敏感,阿托伐他汀治疗在限制 YAP 高 PDX 肿瘤方面比 YAP 低 PDX 肿瘤更有效,表明 YAP 高表达的肿瘤对 MVA 通路的抑制表现出敏感性。

图片来源:Mol Cell
总的来说,该研究团队揭示了 YAP 驱动的肿瘤中甲羟戊酸通路的代谢依赖。YAP 靶基因 ZMYND8 与 SERBP2 相互作用,激活甲羟戊酸途径。这些发现为应用甲羟戊酸通路抑制剂(他汀)治疗 YAP 高活性肿瘤提供了理论依据。
本周推荐:
三句话读懂一篇 CNS:新疗法助力治疗女性不育;能负载活细胞的冷冻微针治疗技术;发现治疗心肌梗死新靶标,...
论文出处:
Pan et al., The ZMYND8-regulated mevalonate pathway endows YAP-high intestinal cancer with metabolic vulner-ability, Molecular Cell (2021), https://doi.org/10.1016/j.molcel.2021.04.009
题图来源:站酷海洛 Plus