Nature 三连发:竞争消除,有你没我,论癌细胞的「霸道行为」
丁香学术
294
结直肠癌 (CRC) 是胃肠道中常见的恶性肿瘤,其形成也是一个逐步发展的过程。前期研究数据表明,大多数结直肠癌起始于异常的腺窝,后逐渐演变成息肉,最终发展为结肠直肠癌,整个过程可长达 5 - 15 年。在内在分子机制层面,大多数结直肠癌是通过 WNT 通路的永久激活而启动的,而这种激活通常是发生在肠道干细胞中肿瘤抑制基因 APC 的突变之后。
APC 的突变可诱导肠内细胞增殖增加,防止细胞死亡并阻断分化,所有这些特征均可能有助于提高 APC 突变细胞的相对适应度,APC 突变的肠道干细胞及其后代显著增加并填充隐窝,最终在那里启动肿瘤的形成。考虑到直接靶向 WNT 信号通路的固有困难,截至目前,并没有对结直肠癌非常有效的治疗策略。
2021 年 6 月 3 日,来自荷兰阿姆斯特丹大学医学中心等单位的研究团队在国际顶尖期刊 Nature 发表了题为 Apc-mutantcells act as supercompetitors in intestinal tumour initiation 的研究性文章, 该团队通过结合体外类器官培养和体内克隆动力学的详细分析,系统深入地研究了 Apc 突变克隆如何发挥其与野生型肠道干细胞相比的竞争优势,并最终为靶向治疗结直肠癌奠定了基础。

图片来源: Nature
主要研究内容
Apc 突变体具有明显的竞争优势
首先,研究人员建立了 WT 和 Apc−/−的共培养体系,他们发现,WT/WT 共培养物的相对贡献随着时间的推移基本保持不变;而 Apc−/−类器官在与 WT 类器官共培养物中迅速占主导地位。进一步的分析发现,这种现象不仅仅是由不同的 Apc−/−和 WT 的增殖比率造成的,而且与 Apc−/−细胞共培养时,WT 类器官的扩张率显著降低,这些数据表明 Apc 突变细胞能够显著抑制 WT 类器官的生长。
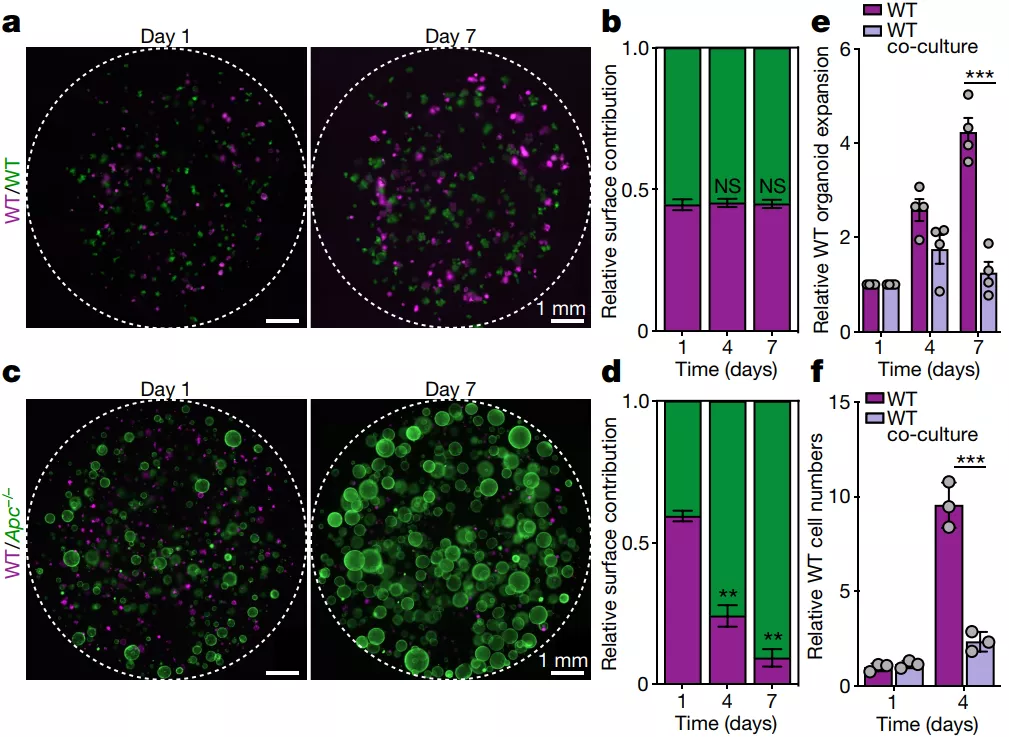
图片来源: Nature
为了进一步了解这种抑制作用,他们实验 WT 或 Apc−/−的条件培养基对 WT 类器官进行孵育并进行转录组分析,结果发现,Apc−/−条件培养基孵育的 WT 类器官显示出干性下降和分化增加的特征,更关键的是,Apc−/−细胞在降低了干细胞的功能同时也显示出明显的克隆能力降低。总之,这些数据揭示了 Apc 的突变可以通过促进分化和减少干细胞数量,积极抑制 WT 类器官的生长和克隆性。
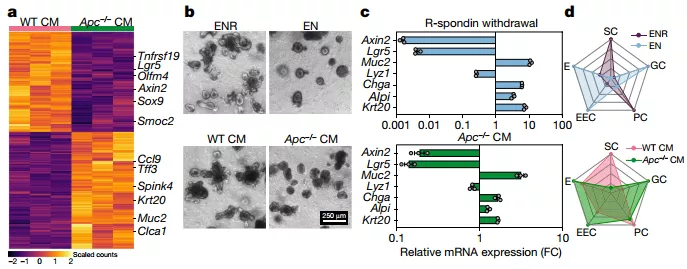
图片来源: Nature
Apc 突变体可分泌 WNT 拮抗剂
接下来,对小鼠 WT 和 Apc−/−类器官的转录组进一步分析显示,Apc 的丢失伴随着几种 WNT 拮抗剂的显著上调,这一现象也在小鼠腺瘤组织中得到了重现。WNT 拮抗剂的上调,使其在生理环境中调节 WNT 水平,并进一步影响肿瘤的发生发展。后续 WNT 拮抗剂和抑制剂的实验也进一步支持了增强 WNT 的激活可能是限制 Apc 突变克隆在体内竞争优势的一种方法。
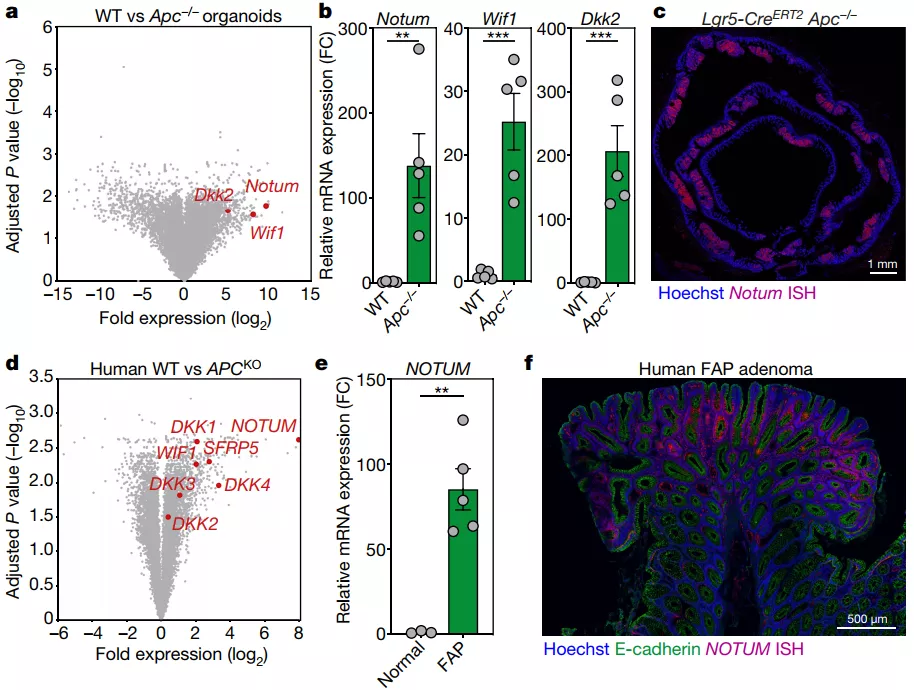
图片来源: Nature
研究总结
总而言之,在这项研究中,他们发现 Apc 突变的细胞表现出了超级竞争优势的特性,因为它们能够使野生型肠道干细胞从隐窝中消失,并由突变型取而代之。同时,他们还检测到 Apc 突变细胞通过分泌多种细胞因子诱导野生型肠道干细胞表现出 WNT 拮抗效应,这也为降低肠癌高危个体的癌症发病率提供了一个潜在的有效策略,特别是具有种系 APC 突变特征的患者。推而广之,识别和抑制产生超级竞争表型的恶性前克隆的信号可能是各种癌症综合征的有效预防策略。
剑桥大学从另一维度揭示肿瘤中「细胞竞争」的现象
同样是研究肠道干细胞的这种「细胞竞争」,来自剑桥大学等单位的科学家们则从肿瘤微环境的角度出发,并借助 Red2Onco 系统来追踪原癌基因驱动的肠道干细胞微环境的重塑在结直肠癌中的作用。该研究以 Tracing oncogene-driven remodelling of the intestinalstem cell niche 为题,作为研究性文章发表在同期 Nature 上。

图片来源: Nature
肿瘤微环境构成了一个复杂的生态系统,包括突变型和野生型细胞,以及内皮细胞、免疫细胞和间充质细胞等。从肿瘤形成的最初阶段开始,肿瘤微环境就适应来自肿瘤细胞的信号,然而,这些变化如何影响非恶性细胞却知之甚少。当前,在哺乳动物中,肿瘤发展过程中的细胞竞争受到越来越多的重视,在癌基因驱动下,突变细胞和非突变细胞是如何发生相互作用的,以及肿瘤微环境是如何影响邻近的野生型细胞仍然有待进一步的研究。
主要研究内容
此前,细胞标记策略已被设计用于研究肿瘤发展过程中的命运变化,但这种方法很难评估肿瘤微环境中的野生型细胞是如何对肿瘤生长做出反应及其与肿瘤细胞的相互作用。为了研究突变体和野生型细胞之间的「交叉对话」,该团队引入了这种可诱导的 Red2Onco 系统,Red2Onco 能够使得癌基因在红色荧光蛋白 (Red Fluorescent Protein, RFP+) 标记的克隆中特异性共表达。
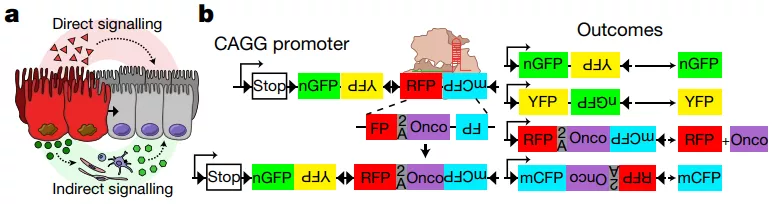
图片来源: Nature
接下来,研究人员借助 Red2Onco 系统研究了肠道干细胞中的突变克隆是否影响相邻隐窝中野生型克隆的命运。结果发现,突变细胞能够介导野生型细胞动力学的变化,同时,接近突变隐窝的野生型克隆显示出加速漂移,大大超过远端野生型隐窝。
图片来源: Nature
随后,为了明确突变克隆是对野生型克隆串扰的机制,他们利用 Red2Onco 系统结合单细胞转录组测序进行了研究,通过将实验组与对照组小鼠的单细胞 RNA 测序数据相结合,他们发现了上皮细胞、基质细胞和免疫细胞中基因表达突变驱动的变化的证据,同时发现干细胞诱导分化是一种潜在的驱动因素,而突变克隆则会驱动肿瘤微环境的重塑。
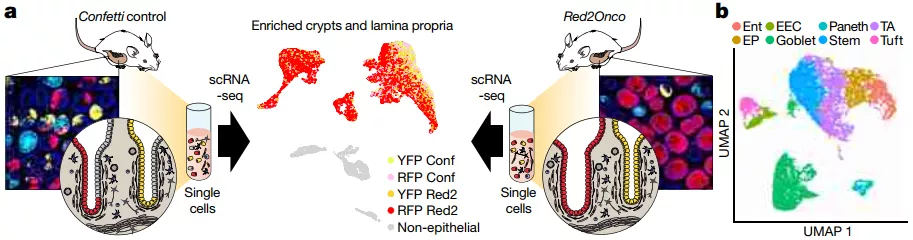
图片来源: Nature
最后,为了验证上述的发现,研究人员通过干预 WNT 和 BMP 通路的下游靶基因以及使用抑制剂直接干扰 WNT 和 BMP 通路,结果发现,这些外界的干预均可以阻止原癌基因驱动的肿瘤微环境重塑,进一步验证了上述的研究发现。

图片来源: Nature
研究总结
综上所述,这项研究表明,突变细胞可能通过远程旁分泌信号,直接或通过癌基因驱动的肿瘤微环境的改变,直接或间接影响相邻区域的野生型细胞,从而对这种肿瘤微生态系统进行重构。
英国比森癌症研究所鉴定出 Apc 突变早期阶段的关键媒介
第三篇题为 NOTUMfrom Apc-mutant cells biases clonal competition to initiate cancer 的研究性文章则来自英国比森癌症研究所等单位,与上述两项研究不同,他们对结直肠癌关键突变基因 Apc 的中间媒介做了深入研究。

图片来源: Nature
主要研究内容
首先,通过转录组测序分析,研究人员发现 NOTUM 基因是 Apc 突变早期阶段的一个显著上调基因。而 NOTUM 本身是可以通过去除 WNT 上棕榈酸酯修饰的羧酸酯酶或者抑制 WNT 与其受体结合,使 WNT 通路丧失功能。这一现象与上述两项研究相似,即 Apc 的突变会导致 WNT 通路的拮抗。

图片来源: Nature
随后,他们通过小鼠模型和体外实验均发现 NOTUM 可以显著抑制野生型细胞而非 Apc 突变细胞的生长,这种竞争优势现象同样和上述研究相似。在机制层面,他们发现 Apc 突变型细胞可以调控 WNT 信号的关键旁分泌负因子,进而抑制野生型肠道干细胞的功能。

图片来源: Nature
最为关键的是,NOTUM 是肿瘤形成所必需的。通过抑制 NOTUM,可以显著削弱肿瘤的定位和进展,进一步说明了 NOTUM 是驱动 Apc 突变克隆固定的主要介质,因此可以作为未来治疗 Apc 突变引起的肠道肿瘤的治疗靶点。
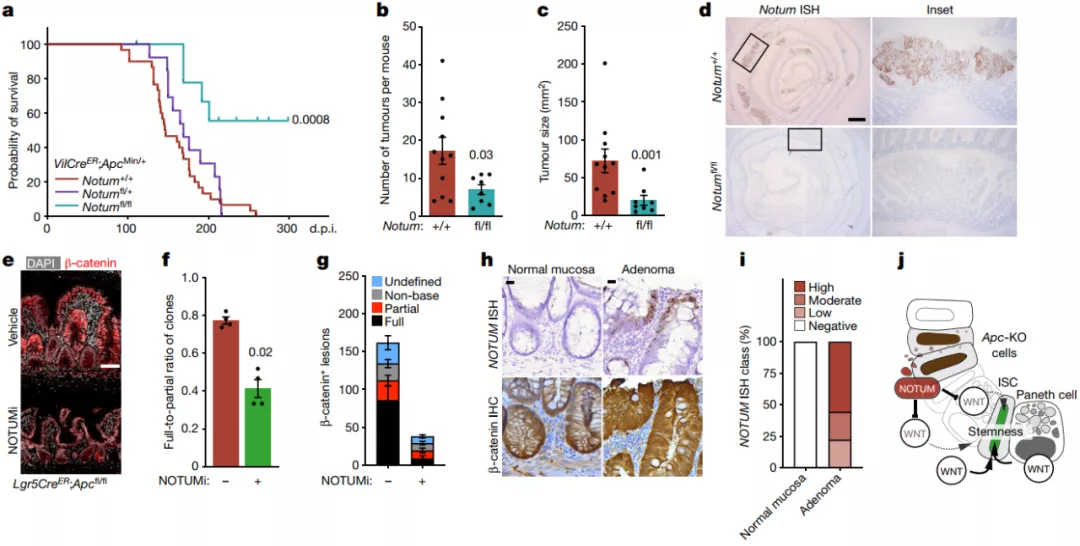
图片来源: Nature
结语
结合三项研究,我们不难发现由原癌基因突变本身及其驱动的微环境改变均可通过一种竞争优势干扰相邻野生型细胞,并最终促进了肿瘤的发生发展。这种「细胞竞争」的现象为肿瘤的发生机制提供了另一个维度的解释,同时也为未来肿瘤的靶向治疗提供了新的研究方向。
参考文献
题图来源:站酷海洛 Plus