「癌细胞」:是我杀了我?PNAS 这项研究竟让肿瘤自己杀死自己
丁香学术
318
在过去的 20 年中癌症治疗发生了显著的变化,靶向治疗通过直接靶向癌症相关通路,提供了具有更高特异性的癌症治疗,其中包括单克隆抗体,细胞因子和小分子抑制剂等生物制剂。但是典型的系统给药,可能损害健康的组织或器官。
为了克服这些缺点,于是需要能限制全身药物暴露,增强肿瘤穿透和滞留的新药物传递系统。因此,基因和细胞治疗(CAR-T 或造血干细胞治疗)迅速成为新的具有巨大潜力的癌症治疗策略,它们可以通过直接赋予患者细胞或组织抗癌特性从而克服传统药物的许多限制。但是病人衍生的细胞扩增需要高额费用与后勤保障,使其无法成为标准治疗方法。
那么是否能够在肿瘤内产生生物制剂,随后扩散并在局部发挥作用呢?
2021 年 5 月 17 日,苏黎世大学 Andreas Plückthun 团队在 PNAS 上发表题为 The SHREAD gene therapy platform for paracrine delivery improves tumor localization and intratumoral effects of a clinical antibody 的研究论文。
图片来源:PNAS
本研究通过 SHREAD 成功成产了具有生化和生物物理特性的重组治疗抗体,与直接注射抗体相比,从肿瘤微环境中生产的抗体更少分泌到体循环中,使肿瘤内形成孔隙和高度多孔的血管系统,具有更好的治疗效果。并且通过共聚焦 3D 显微镜,使这种递送策略的生物分布和治疗效果可视化。
研究内容
腺病毒旁分泌生物制剂
研究人员首先利用一种旁分泌的 adenovirus serotype 5(Ad5)病毒平台,通过外源添加的双特异性适配器的锚蛋白重复蛋白(DARPins),将 Ad5 重新定位识别肿瘤细胞表面的标记物 HER2。采用基于三聚体单链可变抗体片段(scFv)的可逆屏蔽,使病毒粒子从肝脏脱靶,并保护其免受免疫机制的清除。
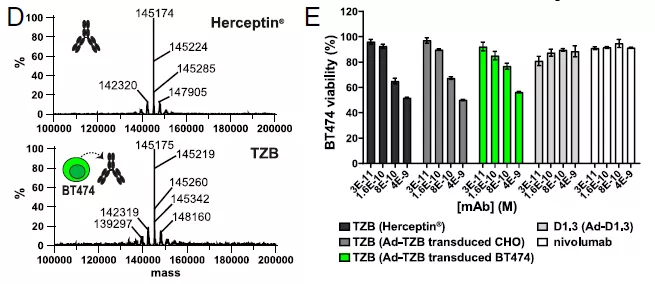
研究人员利用这些成分设计了 SHielded, REtargeted ADenovirus(SHREAD) 基因治疗平台。使用临床批准的抗 HER 抗体 trastuzumab(TZB)作为模型单抗,在非复制腺病毒基因组中编码 TZB。随后用全长 IgG1 TZB(Ad-TZB)转导 BT474 细胞,纯化抗体进行 ESI-MS 分析发现与临床重组 TZB(Herceptin)具有相似的分子特性。

图片来源:PNAS
BT474 作为 HER2 阳性肿瘤模型
为了确定用于旁分泌研究的最佳肿瘤模型,研究人员评估了两种 HER2 阳性肿瘤细胞系(SKOV3ip 和 BT474)的 HER2 水平,转导效率,抗体表达水平和 TZB 敏感性。结果发现相对于对照细胞系,HER2 水平在 BT474 细胞系中最高。天然腺病毒受体水平在对照 HEK293 细胞中最高,在 A549 和 BT474 细胞中分别降低 57% 和 67%,而在 SKOV3ip 中最低。体外转导效率方面,BT474 细胞中 HER2 转导水平最高。
为了检测抗体本身的有效性而不产生任何间接影响,需要一个对直接信号抑制敏感的细胞系。细胞增殖实验结果表明只有 BT474 细胞系对 TZB 敏感,并且对其他无关抗体 nivolumab 不敏感。因此,研究人员选择 BT474 细胞系作为体内旁分泌研究的肿瘤模型。
为了确定这些病毒转导的细胞系是否能产生功能性抗体,一组细胞系在体外转导具有同样感染复数的每一种病毒,72 小时后通过 ELISA 分析细胞上清。结果发现从 Ad-TZB 感染的 BT474 细胞系上清中纯化的 TZB,与体外重组 Herceptin 具有相似的质谱结果,并且还表现出相似的肿瘤细胞抑制效果。
图片来源:PNAS
TZB 旁分泌传递导致体内肿瘤生长延迟
研究人员进一步进行小鼠实验,小鼠注射 BT474 细胞系后分别用 HER2 重靶向和屏蔽病毒(Ad-TZB 或 Ad-D1.3)或重组 Herceptin 进行治疗。结果发现在对照 Ad-D1.3 和 PBS 处理小鼠中肿瘤生长速率快,而 Ad-TZB 和 Herceptin 处理小鼠则导致肿瘤生长延迟。

图片来源:PNAS
光学清除 BT474 肿瘤的成像细胞术
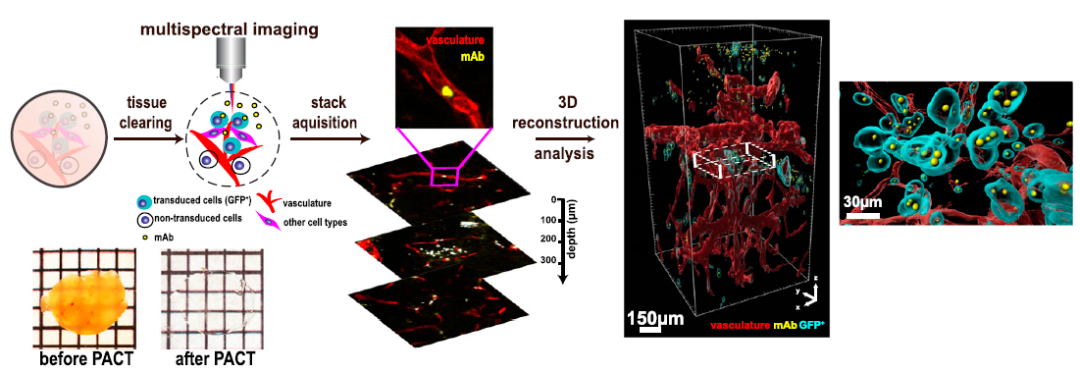
PACT(passive CLARITY)成像技术包括原位和提取后组织标记、保持和清除。研究人员使用 PACT 结合共聚焦成像来可视化和数字化重建肿瘤微环境,从而量化给药治疗的效果。
为了研究肿瘤的细胞组成,研究人员首先构建了 TdTomato 报告细胞系(BT474-TdTomato),通过 FACS 选择中度表达的转导细胞系。然后将 BT474-TdTomato 移植给另一组小鼠,在处理 11 天或 61 天后收集,通过 PACT 制备小鼠肿瘤和肝组织,使组织完全透明。如果表达报告基因或 HER2 染色阳性,则将细胞归类为 BT474 肿瘤细胞。
图片来源:PNAS
为了确定 HER2 重靶向适配器在体内对肿瘤细胞转导特异性影响,通过 PACT 在 Ad-D1.3 处理肿瘤中检测 BT474-TdTomato 肿瘤切片。发现 93.7% 的 Ad-D1.3 转导细胞是 BT474 肿瘤细胞,而 6.33% 是小鼠来源基质细胞,进一步证明了 HER2 重靶向的特异性。

图片来源:PNAS
旁分泌显著降低全身治疗性抗体浓度
为了进一步探究了与直接注射 Herceptin 相比,旁分泌给药 TZB 的生物分布。研究人员从早期和实验终点两种情况下进行可视化观察。结果发现在这两个时间点,肿瘤细胞分泌的 TZB 单抗在整个肿瘤中弥散分布,对 BT474 细胞产生自分泌和旁分泌作用。
图片来源:PNAS
由于肝脏是单抗清除的主要部位,因此研究人员测量肝组织中的 TZB 水平。定量实验结果发现,与直接给药 Herceptin 相比,旁分泌途径导致肿瘤与肝脏的 TZB 浓度比例更高。
此外研究人员还测定不同时间点 TZB 浓度。结果发现在瘤内直接给药 Herceptin,直到第 16 天血浆单抗浓度一直保持高水平。相反的是,Ad-TZB 治疗血浆单抗水平在所有时间点都显著降低(60-110 倍),而肿瘤内 TZB 是持续产生的。通过比较两种方法,确定旁分泌给药组织中单抗相对水平,第 11 天肿瘤中 TZB 升高 21 倍,血浆中降低 89 倍,肝旁分泌释放降低 2.2 倍。在治疗传递方面,相当于单抗从肿瘤到血浆的浓度梯度增加 1800 倍,从肿瘤到肝脏增加 48 倍。
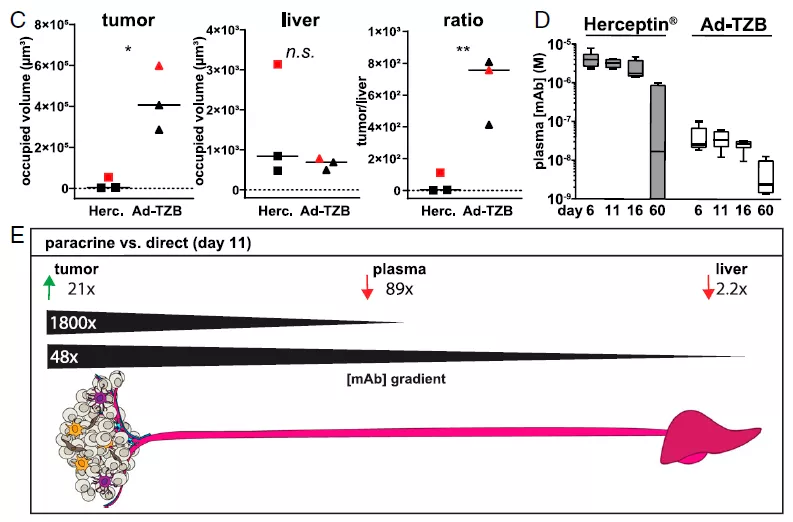
图片来源:PNAS
旁分泌释放导致肿瘤和脉管系统中 TZB 诱导的孔隙形成增加
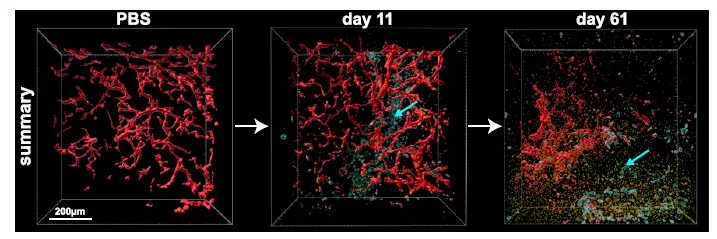
为了进一步了解 TZB 旁分泌给药与直接给药在治疗效果方面的差异,研究人员从肿瘤内部观察,并测量了免疫缺陷小鼠清除肿瘤的两个治疗参数,肿瘤内部气孔的形成和血管系统的完整性。与直接给药处理相比,Ad-TZB 处理的小鼠肿瘤孔隙形成增加,并且破坏了血管系统。
为了量化抗血管生成的作用,研究人员测定了各治疗组第 11 天和 61 天血管系统的孔隙指数。结果发现第 11 天,与 PBS 肿瘤相比,Herceptin 和 Ad-TZB 治疗的孔隙率分别增加了 2 倍和 7 倍,而第 61 天则分别增加了 4 倍和 16 倍。这些结果表明与直接给药治疗相比,使用旁分泌给药(Ad-TZB 治疗)的肿瘤在其内部表现出更显著的治疗效果。
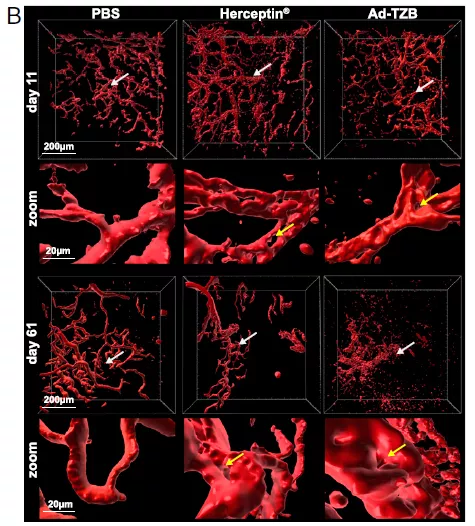
图片来源:PNAS
研究结论
本研究表明,与直接给药相比,原位生产治疗性抗体(称为旁分泌释放)可以在肿瘤内实现较好的定位,仅少量扩散到体循环,因此会有更显著的治疗效果。该研究揭示了旁分泌释放后表达的抗体从肿瘤内部诱导治疗效应(即孔道形成和血管效应),为 SHREAD 释放平台在癌症治疗中的其他应用提供了强有力的理论基础。
参考文献
Sheena N. Smith et al. PNAS. The SHREAD gene therapy platform for paracrine delivery improves tumor localization and intratumoral effects of a clinical antibody. Doi: https://doi.org/10.1073/pnas.2017925118.