颠覆认知!为了生存,癌细胞竟主动断裂 DNA,Science 研究揭开背后机制
丁香学术
癌症治疗中,有一类方法通过造成广泛的 DNA 损伤,可以使癌细胞失活并死亡,这类方法被称为基因毒性疗法。其中,放射治疗是标准肿瘤治疗中应用最广泛的基因毒性疗法。
放射治疗中的能量辐射会引发 DNA 广泛损伤,通常以双链断裂(double-strand breaks, DSBs)、单链断裂(single-stranded breaks,SSBs)和 DNA 链间交联的形式出现。这些损伤可能对细胞造成不可修复的损伤,触发细胞死亡或细胞周期退出。
然而,在临床上,癌症放疗的耐药性仍然是癌症治疗中相当大的障碍,因为癌细胞部署了一系列机制,以减轻放疗造成的损伤,但我们对这些机制尚不完全了解。
2022 年 4 月 28 日,丹麦哥本哈根大学生物技术研究与创新中心的 Claus Storgaard Sørensen 实验室在 Science 杂志发表研究论文 Cancer cells use self-inflicted DNA breaks to evade growth limits imposed by genotoxic stress,该研究为癌症放疗耐药性背后的机制提供了一种新的见解。
该论文基于癌细胞中人类核酸酶文库,筛选到了一个以往认为与 DNA 损伤应答(DNA damage response,DDR)或细胞周期检查点控制无关的靶点——caspase 激活的 DNA 酶(caspase-activated DNase, CAD)。进一步研究发现,CAD/ICAD(inhibitor of CAD,CAD 抑制)信号通路是基因毒性应激后导致 DNA 可逆地断裂增加以发挥检查点控制的原因,为放射的肿瘤细胞提供了又一生路!
图片来源:Science
主要研究内容
细胞周期检查点是真核细胞周期中的「监察」机制,可确保细胞复制正常进行。正常细胞受基因毒性伤害时激活 G1 期检查点基因来保护自己,但癌细胞中的这些检查点基因通常失活。因此,癌细胞特别依赖于 G2 期检查点保护自己免受基因毒性伤害。
外源性 DNA 损伤后,CAD 促进内源性 DNA 断裂
为了鉴定外源性损伤后 G2 期检查点的潜在核酸酶调节因子,研究人员筛选了一个癌细胞中已知的人类核酸酶的文库。出乎意料的是,研究人员筛选到关键靶点 CAD,CAD 是在细胞凋亡过程中引起 DNA 发生片段化的一种双链特异性核酸内切酶。研究团队发现,癌细胞在辐射后大约 12 到 18 小时出现 DNA 断裂,而 CAD 会在辐射导致的外源性 DNA 损伤后促进一波内源性 DNA 断裂。
为了验证这一点,研究人员辐照人类野生型和 CAD 敲除结直肠癌 HCT116 细胞,并通过彗星实验(单细胞凝胶电泳)和原位缺口翻译法来量化 DNA 断裂程度。结果发现相对于 CAD 敲除细胞,野生型细胞中检测到 DNA 损伤的明显累积,在 IR 后 24 小时明显出现,而且 DNA 断裂的程度取决于 IR 的剂量、CAD 核酸酶活性。这表明外源性 DNA 损伤后细胞内源性 DNA 断裂依赖 CAD。
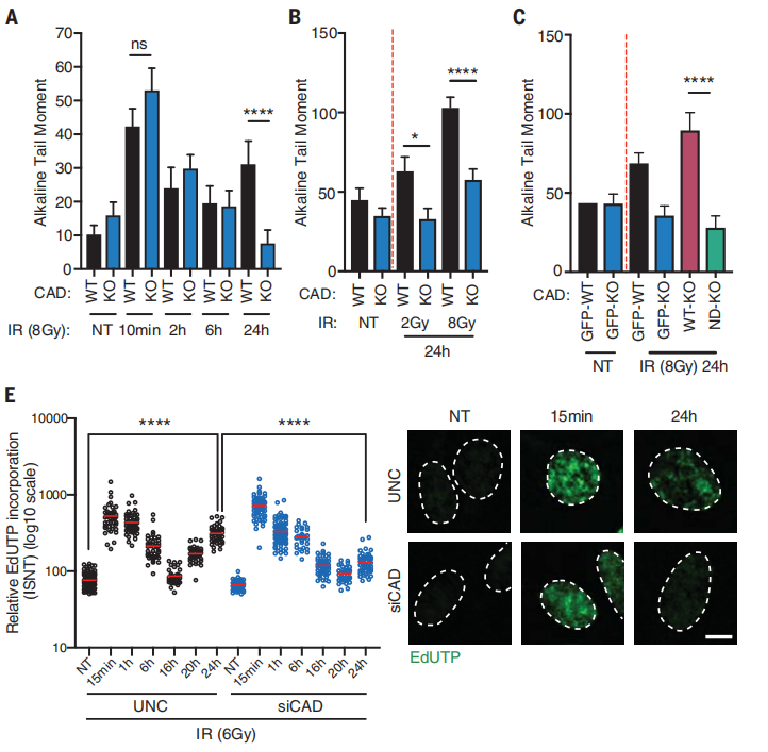
图片来源:Science
基因毒性应激后 DDR 信号通过 ICAD 协调 CAD 活性
CAD 通常存在于 ICAD 的蛋白质复合物中,研究人员观察到 ICAD 和 CAD 都以相似的动力学被招募到 DNA 断裂的亚核区域。出乎意料的是,研究人员注意到在没有 CAD 的情况下,IR 后 ICAD 也可以被招募到染色质上,这表明了可能招募 CAD 部分是由 IR 后的 ICAD 介导的。
那么 CAD 和 ICAD 是否嵌入到 DDR 信号机制中呢?研究人员注意到,ATM 和 ATR 激酶活性的抑制或丢失可以限制 CAD/ICAD 的募集,减少相应的 DNA 断裂数量。为了确定 ATR 是否更直接地调控 ICAD,研究人员分析了 ICAD 的序列并确定了两个潜在的 ATM/ATR 磷酸化位点,Ser107 和 Ser257。研究人员发现在细胞暴露于 IR 后,这两个位点都出现了广泛的磷酸化,并且磷酸化依赖于 IR 后 24 小时 ATM 和 ATR 激酶的活性。
这表明 ATR/ATM 依赖的 ICAD 磷酸化在功能上有助于调节诱导 DNA 断裂,并在 IR 后通过 CAD/ICAD 继续控制检查点。

图片来源:Science
CAD 是 IR 后细胞周期检查点控制和肿瘤细胞存活所必需的
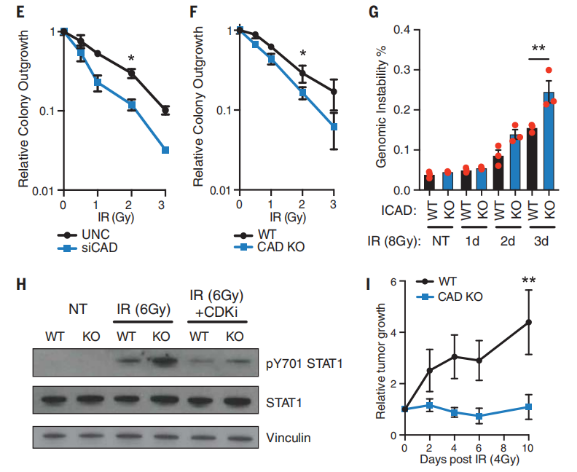
接下来,研究人员研究了 CAD/ICAD 依赖的 G2 细胞周期检查点维持的作用。研究人员证实了在 IR 后 24 小时,CAD 缺陷细胞的 G2 检查点控制失败最为明显,这与研究人员观察到的 CAD 造成的 DNA 断裂的峰值相一致。DNA 双链断裂未及时修复,有丝分裂过早进入会导致有丝分裂细胞死亡,这使得细胞的放疗敏感性提高。事实上,缺乏 CAD 或 ICAD 表达的癌细胞就表现出更高的放射敏感性。
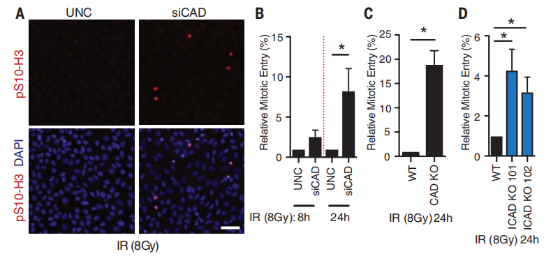
图片来源:Science
此外,研究人员注意到 G2 细胞周期检查点控制的缺失导致不稳定核的发生率增加。这种基因组的不稳定性被认为是激活炎症性 STAT1 信号的一个强有力的分子模式信号。因此,研究人员评估了在野生型和 CAD 缺陷细胞中,发现 IR 后 STAT1 位点 Tyr701 的激活磷酸化。这表明,在 IR 后,CAD 缺陷细胞中 p-Tyr701 STAT1 升高,这依赖于有丝分裂的进展。这些观察结果与最近的研究一致,表明辐射后有丝分裂的过早进展促进了 STAT1 信号传导。
图片来源:Science
研究人员进一步分析了体内肿瘤放疗模型中的 CAD 功能。与基于细胞的生存评估一致, CAD 缺乏的肿瘤在照射后对肿瘤生长有显著的负面影响。与野生型肿瘤相比,放射后的 CAD 缺陷肿瘤在终点显示 p-Tyr701 STAT1 升高。总的来说,这些结果支持了 CAD 依赖的途径在 IR 后积极促进癌细胞存活的发现。
结语
综上所述,在这项研究中,研究人员发现了 DNA 损伤应答介导的有丝分裂 G2 期检查点通路,当暴露于电离辐射时癌细胞发生可逆的 DNA 断裂,防止过早进入有丝分裂期,从而提高癌细胞的存活率。这一过程依赖 CAD,CAD/ICAD 介导的途径反映了在肿瘤发生过程中对基因组不稳定的选择压力的适应,并导致了肿瘤治疗耐药性。
这种促生存的检查点通路也揭示了癌症的脆弱性,为靶向 G2 期检查点提高肿瘤细胞放射敏感性提供了潜在的途径。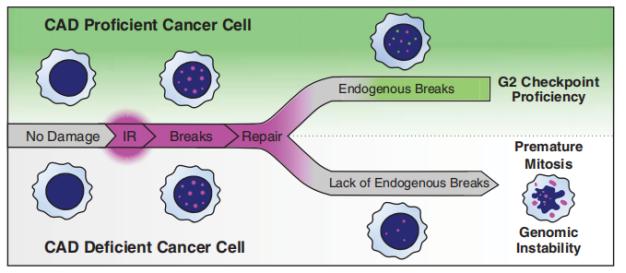
图片来源:Science




![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)