Cell Metab:肥胖的元凶或许是免疫稳态的紊乱?来自哈佛的科学家给出了最新的解释
丁香学术
131
导读
肥胖,已经成为威胁人类健康的全球性公共卫生问题,肥胖者容易出现包括 2 型糖尿病(T2D)、心脏病和中风在内的一系列代谢相关的疾病,其中,脂肪组织的慢性、低度炎症,是肥胖相关代谢紊乱的主要驱动因素。
瘦人的内脏脂肪组织(Visceral Adipose Tissue, VAT)富含各类免疫细胞,如抗炎巨噬细胞,2 型先天性淋巴样细胞和调节性 T 细胞(Treg),这些细胞可以抑制炎症,以维持组织稳态。
但是在肥胖状态下,这种抗炎状态就会被扰乱,导致某些促炎免疫细胞的积累。然而,肥胖是如何使免疫系统的抗炎部分无法适当控制炎症和维持脂肪组织稳态的呢?
2021 年 7 月 12 日,哈佛医学院免疫学系等单位的科学家们在 Cell Metabolism 在线发表了题为 Interferon-a-producing plasmacytoid dendritic cells drive the loss of adipose tissue regulatory T cells during obesity 的文章。
该研究借助小鼠模型,探索了肥胖过程中,Treg 细胞的动态变化,并在分子层面揭示了驱动其重构的因素,为改善肥胖引起的代谢紊乱及靶向相关疾病具有重要指导意义。

图片来源:Cell Metabolism
主要研究内容
Foxp3+CD4+ Treg 是瘦人体内 VAT 抗炎状态的关键守护者,是调节肥胖相关炎症和代谢异常的主要促进因子之一,具有独特的特异性抗原识别特征。
但在严重肥胖的小鼠中,其比例由 50%-80% 骤降到 10%-20%,其特性亦发生了改变。但是在肥胖过程中,其动态变化以及驱动其发生改变的因素仍然知之甚少。
VAT-Tregs 对 HFD 喂养的反应发生在两个不同的阶段
为了检查内脏脂肪组织调节性 T 细胞(VAT-Tregs)在肥胖的发生、发展和后期阶段的行为,研究人员对 vTreg53TCR-tg 小鼠进行不同的饮食控制:正常饮食(NCD)或者高脂饮食(HFD),后者的处理周期包括 4、8 或 16 周三组。
随后,他们检测了脾脏和 VAT 中克隆型 Tregs 的频率和数量。与预期的一样,HFD 的小鼠比 NCD 的小鼠体重显著增加,VAT 在高脂饲料饲喂 2 周时就显著增加,但在随后的时间(8-16 周)有所减少。此外,在 HFD 小鼠中,VAT-Tregs 的数量在早期阶段(2-4 周)增加,但随后会降到只有大约 20%(8-16 周)。
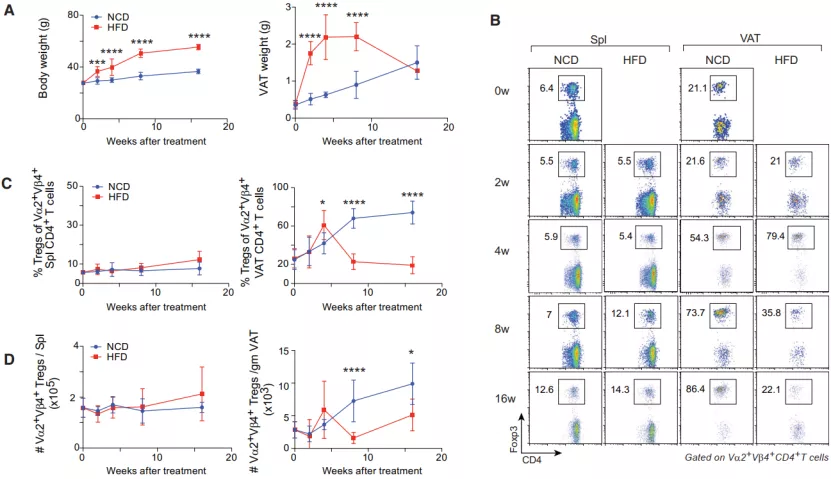
图片来源:Cell Metabolism
接下来,他们通过全转录组测序分析,比较了在 HFD 和 NCD 喂养过程中 Tregs 转录组的动态改变。主成分分析(PCA)结果显示,脾脏来源和 VAT 来源的 Tregs 在转录组层面具有较大差异,此外,脾脏 Tregs 的转录谱在整个过程中保持相当稳定。但是,VAT-Tregs 转录谱却在正常喂食过程中,随着小鼠年龄的增长,逐渐发生改变并与脾脏对应的转录组的差异越来越大。
不过在 HFD 组,VAT-Tregs 的转录谱与脾脏的转录谱在第 2 周和第 4 周时存在较大差异,但随着高脂饲料喂养时间的延长,VAT-Tregs 逐渐失去了明显的特征,在 8 周和 16 周时变得更像脾脏的 Tregs。因此,上述的结果表明,随着 HFD 时间的延长,VAT- Tregs 会发生动态改变,并经历了早期扩张阶段和后期收缩阶段。
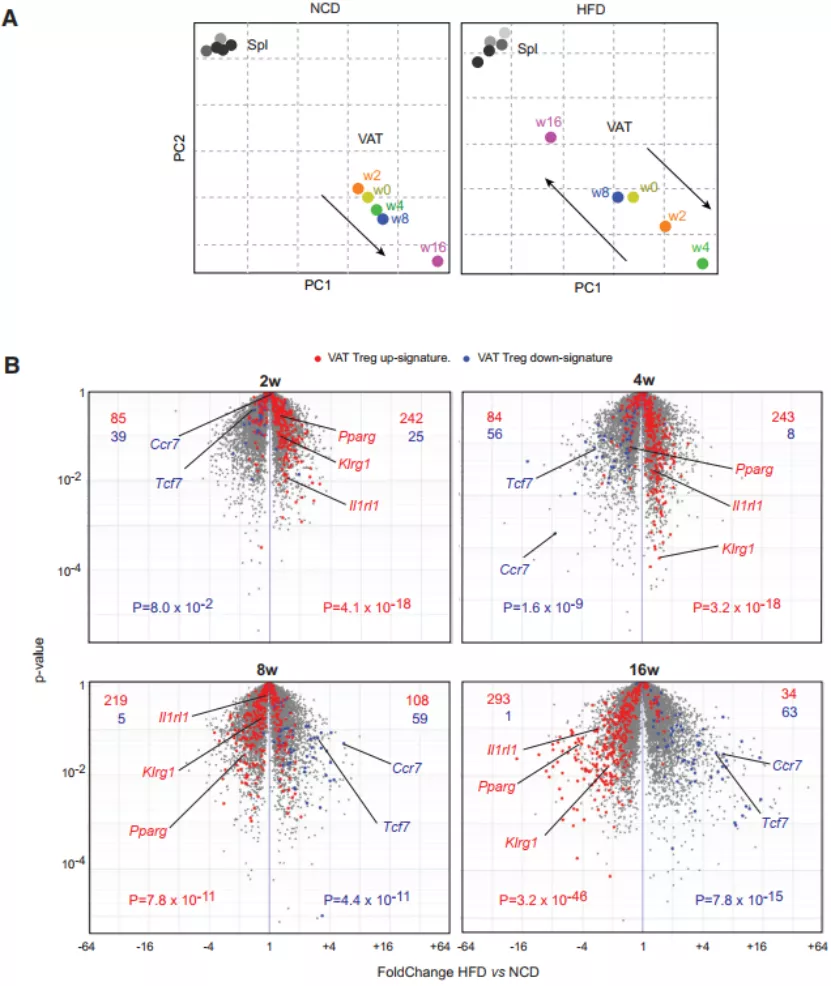
图片来源:Cell Metabolism
肥胖的发生、发展与 VAT-Tregs 细胞增殖和死亡的改变有关
随后,对 RNA-seq 数据的进一步基因富集分析揭示了在肥胖的发生和发展过程中产生变化的通路。HFD 组的 VAT-Tregs 在 2 周时显著富集了与细胞激活和增殖相关的基因,这与它们早期加速积累的现象相一致。
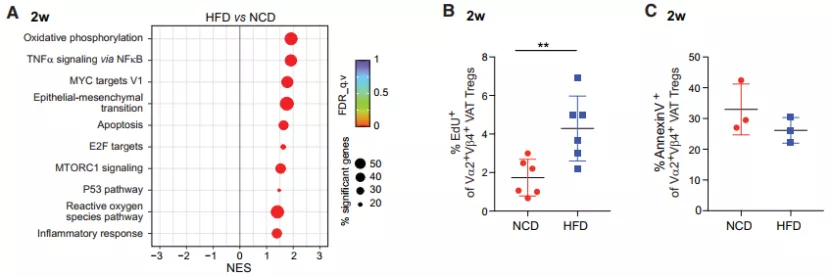
图片来源:Cell Metabolism
但是,喂养 4 周后,HFD 组的 VAT-Tregs 转录组数据分析结果显示,其与增殖和细胞周期相关的转录本相对较低,此外,这时的 VAT-Tregs 已经表现出明显的细胞周期停滞和细胞死亡迹象。
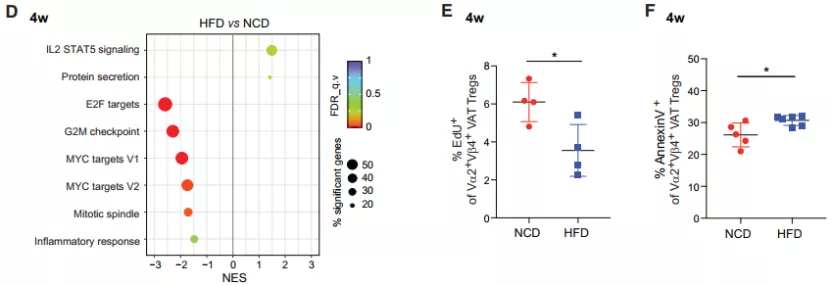
图片来源:Cell Metabolism
长期的 HFD 喂养可改变 VAT-Treg 的特性
在 HFD 喂养 8 周和 16 周后,基因富集分析结果显示了促炎细胞因子信号通路的高表达,如 IFN-a、TNF-a 和 IFN-g 信号通路,而 VAT-Tregs 的已知特征,如胆固醇稳态、过氧化物酶体和脂肪酸代谢途径等则显著降低。

图片来源:Cell Metabolism
对整个实验周期中,来自两组小鼠的 VAT-Tregs 转录组数据中具有差异的转录本进行聚类分析发现,富含编码胆固醇稳态通路的转录本,在 NCD 组一直维持在高水平,但在 HFD 组却随着时间增加而逐渐下调。相反,与 IFN 和 TNF-a 相关的转录本则在长期 HFD 喂养下被诱导高表达,而这在正常喂养组是没有的。
前期的研究表明,PPARg 是 VAT-Tregs 积累和表型的主要驱动因素,正如预期的那样,VAT-Tregs 中 Pparg 转录本在 NCD 小鼠中保持在高水平,但在 HFD 喂养过程中则会随着时间而下降。
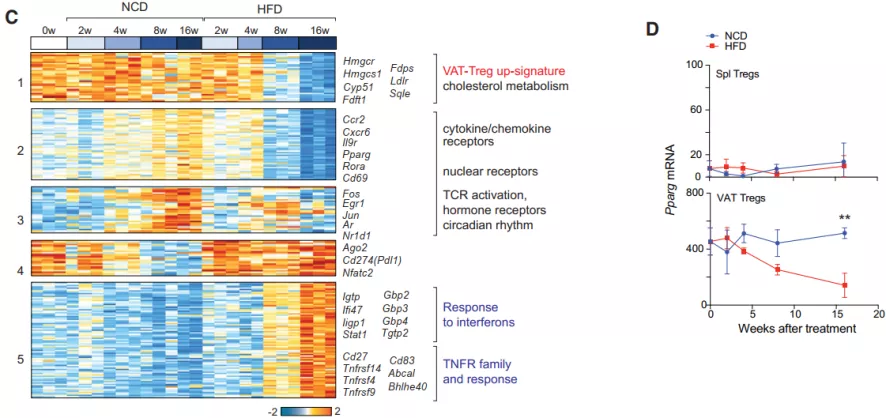
图片来源:Cell Metabolism
促炎细胞因子为影响 VAT-Treg 群体扩增的主要因素
上述的数据显示,在长时间高脂饲料喂养下,促炎细胞因子相关的转录本在逐渐被诱导表达,这促使研究人员去探索添加这些细胞因子是否能抑制 VAT-Tregs 的积累。先前的研究表明,VAT-Tregs 随时间的积累严重依赖于细胞因子 IL-33,而在长期高脂饲料喂养下,VAT 中 IL-33 的含量并没有减少,而是增加。
因此,实验人员推测:促炎细胞因子可能能够拮抗 IL-33 驱动的 VAT-Tregs 扩增。为了验证这个假设,他们对小鼠进行了不同的处理,结果发现,单独注射 IL-33 后,VAT 中 Tregs 出现了的显著的增长,但如果 IL-33 和 IFN-a、TNF-a 或 IFN-g 一起注射,则后者可抑制 IL-33 诱导的 VAT-Tregs 群体的扩增。

图片来源:Cell Metabolism
为了确定哪种促炎细胞因子可以直接拮抗 IL-33 驱动的 VAT-Tregs 的扩增,他们将 PPARg(tdT)+ VAT-Tregs 分选后在体外进行培养,并添加 IFN-a 或 TNF-a 或 IFN-g。结果发现,培养 4 天后,加入 IFN-a 后存活的 Tregs 最少。机制上,对 EdU 掺入和死细胞染色的实验结果显示,IFN-a 抑制了 VAT-Tregs 的增殖和存活,而 TNF-a 和 IFN-g 则没有这种效应。

图片来源:Cell Metabolism
最后,为了确定在长时间高脂饲料喂养下,额外增加的 IFN 是否是 VAT-Tregs 减少的真正原因,他们在小鼠喂食 HFD 的情况下,每周注射 2 次抗 IFNAR1 单克隆抗体(mAb)或 IgG 同型对照抗体(mAb)。
8 周后,检测结果表明阻断 IFNAR1 可以恢复 VAT 中克隆型 Tregs 的比例和数量,但对脾中的没有影响。最后,他们还进一步证实了树突状细胞是 IFN-a 的来源细胞。
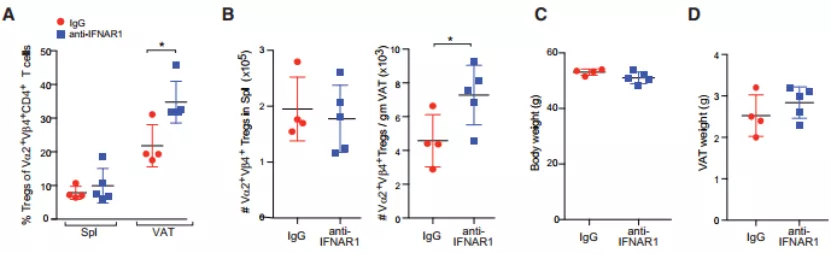
图片来源:Cell Metabolism
结语
VAT-Tregs 的稳态是机体代谢健康的保证之一,在本研究中,通过探索肥胖过程中 VAT-Tregs 转录组特征的动态变化,确定了 VAT-Tregs 对肥胖的反应有两个不同的阶段,阐明了肥胖后期 VAT-Tregs 失调的机制,为治疗肥胖相关的代谢紊乱提供了一个潜在的治疗靶点。

图片来源:Cell Metabolism
题图来源:图虫创意
参考文献
1. Li et al., Interferon-a-producing plasmacytoid dendritic cells drive the loss of adipose tissue regulatory T cells during obesity, Cell Metabolism (2021).
2. Lee, Y.S., Wollam, J., and Olefsky, J.M. (2018). An integrated view of immunometabolism. Cell 172, 22–40.
3. Panduro, M., Benoist, C., and Mathis, D. (2016). Tissue Tregs. Annu. Rev.Immunol. 34, 609–633.