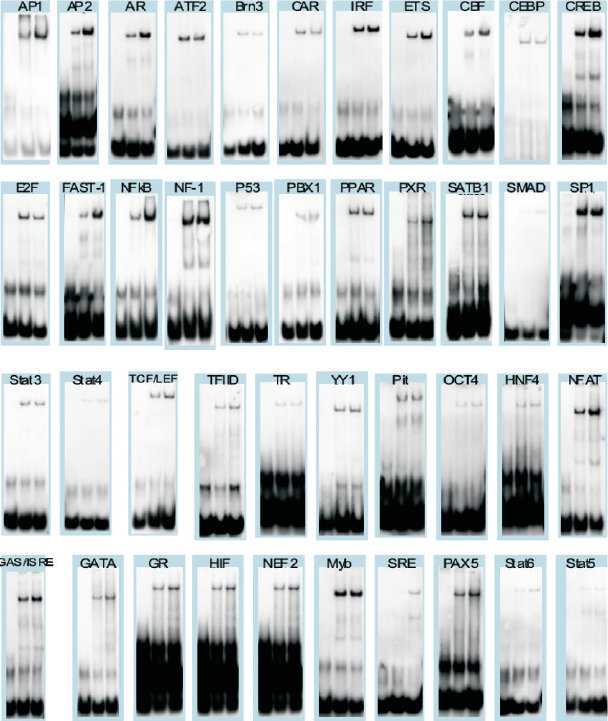
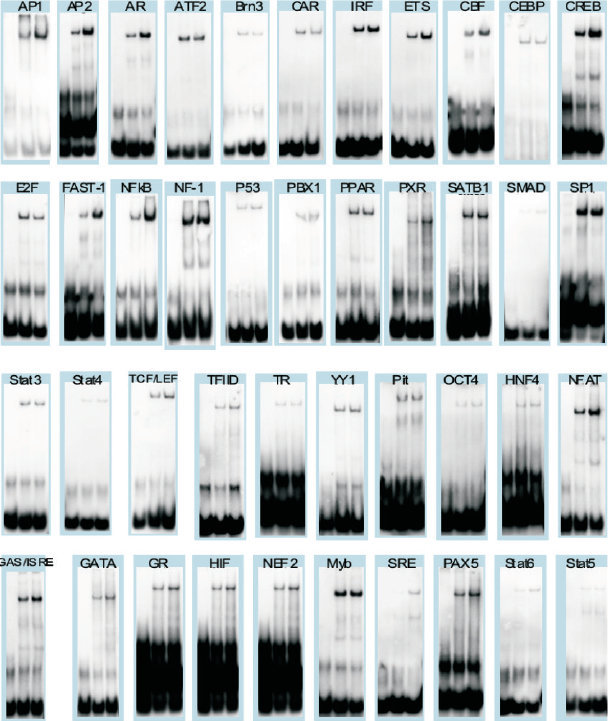
实验时间 | 还在为凝胶迁移实验(EMSA)发愁?老司机为你指路
丁香园
实验步骤
01 探针的标记
如下设置探针标记的反应体系:体系为 10 微升
待标记探针 (1.75 pmol / 微升) :2 微升。
T4 Polynucleotide Kinase Buffer (10×) :1 微升。
Nuclease-Free Water :5 微升。
[γ-32P] ATP(3 000 Ci/mmol at 10 mCi/ml) :1 微升。
T4 Polynucleotide Kinase (5-10 u / 微升) :1 微升。
依次加入各种试剂,加入同位素后混匀,再加入 T4 Polynucleotide Kinase,混匀。
使用水浴或 PCR 仪,37 ℃ 反应 10 分钟。
加入 1 微升探针标记终止液,混匀,终止探针标记反应。
再加入 89 微升 TE,混匀。此时可以取少量探针用于检测标记的效率。通常标记的效率在 30% 以上,即总放射性的 30% 以上标 记到了探针上。为实验简便起见,通常不必测定探针的标记效率。
标记好的探针最好立即使用,最长使用时间一般不宜超过 3 天。
02 探针的纯化
对于 100 微升标记好的探针,加入 1/4 体积即 25 微升的 5 M 醋酸铵,再加入 2 体积即 200 微升的无水乙醇,混匀。
在 -70 ℃ 至 -80 ℃ 沉淀 1 小时,或在 - 20℃ 沉淀过夜。
在 4 ℃,12 000 g~16 000 g 离心 30 分钟。小心去除上清,切不可触及沉。
在 4 ℃,12 000 g~16 000 g 离心 1 分钟。小心吸去残余液体。微晾干沉淀,但不宜过分干燥。
加入 100 微升 TE,完全溶解沉淀。标记好的探针最好立即使用。
03 EMSA 胶的配制
准备好倒胶的模具。最好选择可以灌制较薄胶的模具,便于干胶等后续操作。
配制 20 毫升 4% 的聚丙烯酰胺凝胶。
加入 TEMED 前先混匀,加入 TEMED 后立即混匀,并马上加入到制胶的模具中。避免产生气泡,加上梳齿。如果发现非常容易形成气泡,可以把一块制胶的玻璃板进行硅烷化处理。
04 EMSA 结合反应
如下设置 EMSA 结合反应
(1)阴性对照反应:体系为 10 微升;Nuclease-Free Water :7 微升;EMSA/Gel-Shift 结合缓冲液(5×):2 微升;细胞核蛋白或纯化的转录因子: 0 微升;标记好的探针 :1 微升。
(2)样品反应
(3)探针冷竞争反应
(4)突变探针的冷竞争反应
(5)Super-shift 反应
加入标记好的探针前先混匀,并且室温 (20~25 ℃) 放置 10 分钟,从而消除可能发生的探针和蛋白的非特异性结合,或让冷探针优先反应。然后加入标记好的探针,混匀,室温放置 20 分钟。
加入 1 微升 EMSA/Gel-Shift 上样缓冲液 (无色,10×),混匀后立即上样。
05 电泳分析
用 0.5×TBE 作为电泳液。按照 10 V / 厘米的电压预电泳 10 分钟。预电泳的时若有空余上样孔可加入少量稀释好的 1× 的上样缓冲液,以观察电压是否正常。
把混合了上样缓冲液的样品加入到上样孔内。
按照 10 V / 厘米的电压电泳。确保胶的温度不超过 30℃,如果温度升高,需要适当降低电压。电泳至 EMSA/Gel-Shift 上样缓冲液中的蓝色染料溴酚蓝至胶的下缘 1/4 处,停止电泳。
剪一片大小和 EMSA 胶大小相近或略大的比较厚实的滤纸。小心取下夹有 EMSA 胶的胶板,用吸水纸或普通草纸大致擦干胶板边缘的电压液。把滤纸从 EMSA 胶的一侧逐渐覆盖住整个 EMSA 胶,滤纸和胶压紧。滤纸被胶微微浸湿后揭起滤纸。把滤纸侧向下放平,在 EMSA 胶的上面覆盖一层保鲜膜,确保保鲜膜和胶之间没有气泡。
干燥 EMSA 胶。然后用 X 光片压片检测,或用其它适当仪器设备检测。