这可能是史上最全面的 MTT 大汇总了吧!
丁香园
实验前应明确的问题
1. 选择适当的细胞接种浓度。一般情况下,96 孔培养板的一内贴壁细胞长满时约有 105 个细胞。但由于不同细胞贴壁后面积差异很大,因此,在进行 MTT 试验前,要进行预实验检测其贴壁率、倍增时间以及不同接种细胞数条件下的生长曲线,确定试验中每孔的接种细胞数和培养时间,以保证培养终止致细胞过满。这样,才能保证 MTT 结晶形成酌量与细胞数呈的线性关系。否则细胞数太多敏感性降低,太少观察不到差异。
2. 药物浓度的设定。一定要多看文献,参考别人的结果再定个比较大的范围先初筛。根据自己初筛的结果缩小浓度和时间范围再细筛。切记!否则,可能你用的时间和浓度根本不是药物的有效浓度和时间。
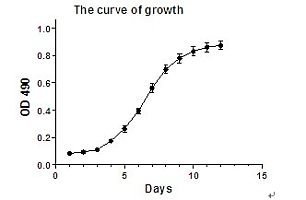
3. 时间点的设定。在不同时间点的测定 OD 值,输入 excel 表,最后得到不同时间点的抑制率变化情况,画出变化的曲线,曲线什么时候变得平坦了(到了平台期)那个时间点应该就是最好的时间点(因为这个时候的细胞增殖抑制表现的最明显)。
4. 培养时间。200ul 的培养液对于 10 的 4~5 次方的增殖期细胞来说,很难维持 68 h,如果营养不够的话,细胞会由增殖期渐渐趋向 G0 期而趋于静止,影响结果,我们是在 48 h 换液的。
5.MTT 法只能测定细胞相对数和相对活力,不能测定细胞绝对数。做 MTT 时,尽量无菌操作,因为细菌也可以导致 MTT 比色 OD 值的升高。
6. 理论未必都是对的。要根据自己的实际情况调整。
7. 实验时应设置调零孔,对照孔,加药孔。调零孔加培养基、MTT、二甲基亚砜。对照孔和加药孔都要加细胞、培养液、MTT、二甲基亚砜,不同的是对照孔加溶解药物的介质,而加药组加入不同浓度的药物。
8. 避免血清干扰。用含 15% 胎牛血清培养液培养细胞时,高的血清物质会影响试验孔的光吸收值。由于试验本底增加,会试验敏感性。因此,一般选小于 10% 胎牛血清的培养液进行。在呈色后,尽量吸净培养孔内残余培养液。
实验步骤
贴壁细胞:
1. 收集对数期细胞,调整细胞悬液浓度,每孔加入 100ul, 铺板使待测细胞调密度至 1000 - 10000 孔,(边缘孔用无菌 PBS 填充)。
2.5%CO2,37℃ 孵育,至细胞单层铺满孔底(96 孔平底板), 加入浓度梯度的药物, 原则上,细胞贴壁后即可加药,或两小时,或半天时间,但我们常在前一天下午铺板,次日上午加药. 一般 5 - 7 个梯度, 每孔 100ul, 设 3 - 5 个复孔. 建议设 5 个,否则难以反应真实情况
3.5%CO2,37℃ 孵育 16 - 48 小时,倒置显微镜下观察。
4. 每孔加入 20ulMTT 溶液(5 mg/ml,即 0.5%MTT),继续培养 4 h。若药物与 MTT 能够反应,可先离心后弃去培养液,小心用 PBS 冲 2 - 3 遍后,再加入含 MTT 的培养液。
5. 终止培养,小心吸去孔内培养液。
6. 每孔加入 150ul 二甲基亚砜,置摇床上低速振荡 10 min,使结晶物充分溶解。在酶联免疫检测仪 OD490nm 处测量各孔的吸光值。
7. 同时设置调零孔(培养基、MTT、二甲基亚砜),对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、二甲基亚砜)
悬浮细胞:
1)收集对数期细胞,调节细胞悬液浓度 1×106 /ml,按次序将①补足的 1640(无血清)培养基 40ul ;②加 Actinomycin D(有毒性)10ul 用培养液稀释 lg/ml,需预试寻找最佳稀释度,1:10 - 1:20);③需检测物 10ul;④细胞悬液 50ul(即 5×104cell/孔),共 100ul 加入到 96 孔板(边缘孔用无菌水填充)。每板设对照(加 100(储存液 100 1640)。
2)置 37℃,5%CO2 孵育 16 - 48 小时,倒置显微镜下观察。
3)每孔加入 10 ul MTT 溶液(5 mg/ml,即 0.5%MTT),继续培养 4 h。(悬浮细胞推荐使用 WST- 1,培养 4 h 后可跳过步骤 4),直接酶联免疫检测仪 OD570nm(630nm 校准)测量各孔的吸光值)
4)离心(1000 转 x10 min),小心吸掉上清,每孔加入 100 ul 二甲基亚砜,置摇床上低速振荡 10 min,使结晶物充分溶解。在酶联免疫检测仪 OD570nm(630nm 校准)测量各孔的吸光值。
5)同时设置调零孔(培养基、MTT、二甲基亚砜),对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、二甲基亚砜),每组设定 3 复孔。
MTT 的配制
MTT 一般最好现用现配,过滤后 4ºC 避光保存两周内有效,或配制成 5 mg/ml 保存在- 20 度长期保存,避免反复冻融,最好小剂量分装,用避光袋或是黑纸、锡箔纸包住避光以免分解。我一般都把 MTT 粉分装在 EP 管里,用的时候现配,直接往培养板中加,没必要一下子配那么多, 尤其当 MTT 变为灰绿色时就绝对不能再用了。
MTT 有致癌性,用的时候小心, 有条件最好带那种透明的簿膜手套. 配成的 MTT 需要无菌,MTT 对菌很敏感;往 96 孔板加时不避光也没有关系,毕竟时间较短,或者你不放心的时候可以把操作台上的照明灯关掉.
配制 MTT 时用用 PBS
PBS 配方:
Nacl 8 g
Kcl 0.2 g
Na2 HPO4 1.44 g
KH2PO4 0.24 g
调 ph 7.4
定容 1L
关于细胞的接种 (铺板)
细胞过了 30 代以后就不要用了, 因为状态不好了; 培养板要用好的(最好进口板),不好的板或重复利用的板只可做预实验。
接种时最好按照预实验摸索出的密度接种, 因为细胞密度在 10000 /ml 左右时,所测得的 OD 值的区间即细胞抑制率(或者增值率)的所呈现的线性关系最好,结果最可信。如果铺的太稀细胞的杀伤不会很明显,太密细胞可能都会凋亡,因为细胞长的太快营养会不够,最后导致死亡。且而细胞过密或者过少,增殖都会过快或者过慢,其增值率线性关系不佳。故而 MTT 细胞密度多采用 10000 /ml,100ul/孔。
细胞密度要根据不同细胞的特点来定. 如果你做的药品对细胞具有刺激作用那么取小点的细胞浓度,如果你做的药品对细胞具有抑制作用那么取大点的细胞浓度,这样与对照的区别更明显,数据更好。悬浮细胞每孔的细胞数可达到 105, 贴壁细胞可为 103 - 104.
其它的声音:
1. 首先细胞的接种密度一定不能过大,一般每孔 1000 个左右就够了,我认为宁少勿多。尤其是对于肿瘤细胞。10000 /孔是太高了,这样即使药物有作用,MTT 方法也是表现不出的,最佳点板浓度在 4000 - 5000 /孔,太少的话 SD 值会很大。
2.MTT 本身就是比较粗的实验,增殖率 10% 左右的波动都不算奇怪。特别是新手,20% 的波动也是常见的,所以很可能是技术原因引起的,特别是种板技术一定要过关。
3. 我做的是肿瘤细胞的 MTT 实验, 这种细胞长的很快一开始我是用 100000 /ML 的浓度来接种的, 结果细胞长的太满结果是没有梯度也没有线性关系. 后来调整浓度, 用过 40000~80000 /ML 的浓度都做过 MTT 实验, 结果发现做的结果比较好点的是 60000~70000 /ML 的浓度组的. 用 40000 /M 的浓度的组, 由于细胞少, 药物作用的梯度还是有, 只是没有很好的线性关系. 还有根据细胞生长速度以及药物的特性 (有时间依赖性和浓度依赖性的药物) 来确定培养时间是 48 小时还是 72 小时.
注意细胞悬液一定要混匀,已避免细胞沉淀下来,导致每孔中的细胞数量不等,可以每接几个就要再混匀一下。加样器操作要熟练,尽量避免人为误差。虽然移液器比移液管精确得多,但是如果操作不熟,CV 会在 8% 左右。另外,吹散次数过多也会影响细胞活力。所以要熟练鞋、快些上板。
首先说说我的一点经验:
1. 吹打时悬液总量不能太多,达到吸管吸液量的 3 到 4 倍,可能比较容易混匀。10 ml 的离心管里面最好装 3~4 ml 的悬液:悬液太少容易吹起很多气泡,悬液太多又不容易吹成单细胞悬液。。。
2. 吸管的吸液量最好在 1 ml 左右:吸液量过多的话,一下吸起很多液体,管中所剩就很少,这样吹打容易起泡,吸液量过少,吹打的力度就不够,吹打就会不均匀。如果是吸液量 1 ml 多的吸管,总液量在 5 ml 左右为益
3. 吸的时候要在悬液底部,然后提起来一点,但是吹下去的时候不要离开液面,否则容易吹打出气泡。
4. 吹打次数 100 左右,就可以吹打均匀了(有人认为加细胞前吹打 30-50 次基本就差不多均匀了。加细胞的时候每接种 2 孔反复吹打 3 次,每吹打 3 次后qiang头垂悬与细胞悬液中 5 秒钟,然后再以一定的速度吸取悬液。)
5. 向每孔中用头加入细胞时不要太快,否则你会发现细胞在加入的瞬间会由于头的冲力在孔底聚集一堆,一般都在孔的底部中央,而周边很少,这种不均匀的分散会产生接触抑制,影响细胞的生长。所以速度不能太快也不能太慢。我习惯每块板加完后平握手中,向左 3 下,向右 3 下,在往返回复 3 下移动,目的是使得细胞能分散的均匀些。(铺板技术是 MTT 实验的关键,也是基础,一定要练好。曾经有同学用漩涡振荡器混匀细胞,最后细胞全死了,建议不要采用这种方法混匀细胞。
加入 MTT
个人认为 MTT 最关键的是你的细胞数目和你加入真正起作用的的 MTT 的适当比例,具体细胞数目和真正起作用的的 MTT 之间的关系确实不好确定,我认为 MTT 多加一些比少加好一些
MTT 的量各家报道不同,一般是过量的,所以 10ul 即够了。如果不使用 96 孔板,培养基超过 100ul,MTT 按照 10% 的比例加入. 加入 MTT 以后振荡一下让 MTT 与培养基混匀,不过这个应该关系不大。
如加入 MTT 后都有个别孔立即变为蓝黑色,则污染的可能性極大, 另外 MTT 稀釋後加入細胞前還是需要以過濾的方式滅菌為宜. 且在加 MTT 前可以先在镜下观察,看看是否有孔染菌,染菌的孔常常是临近的
因为血清中白蛋白对大部分的药物都有结合效应,所以可以单独将药物和 MTT 加在一起,看会不会起反应。如果不起反应,就不用去除含药物的培液,直接加 MTT 即可。
百家争鸣:
1. 加 DMSO 前要把液体吸掉,但培养液里的紫色结晶可能会吸去,可在这之前先用平板离心机离心 96 孔板,2000r,5 分钟,然后吸掉上清 (如果是悬浮细胞,则推荐此法, 悬浮细胞要离心 2500rpm×10 min. 且其做 MTT 最好用圆底型 96 孔板, 清除上清时注意不要把下面的结晶颗粒吸掉, 建议各孔吸弃 150 - 160ul 即可)。
2. 我每次将 MTT 加入后,再孵育四个小时,然后用离心机离心 1000 G,5 min。但是用小心地吸上清,还是会将一小部分蓝色结晶吸出。所以还是建议翻转倒扣的方法吧!
3. 另外,可以直接将板翻转倒扣(垫几层滤纸)2-3 次,比用「吸」的办法更不容易使细胞脱离出来。可以轻拍,或者倾斜一点帮助吸液,发现紫色结晶几乎没有肉眼可见的掉脱,但前提是你本身细胞贴壁要比较牢,半贴壁生长的细胞容易脱离。假如药物作用时间长的话,阴性对照组可能由于细胞过多而使加入MTT后形成的结晶漂起来,这样就不能直接倒掉上清。
4. 做 MTT 时,这一步骤一定要小心,不要采用倒的方式。因为贴壁不牢的细胞会被倒掉,从而影响 OD 值。悬浮细胞,不要翻板,离心后也不要翻板,这个方法害死人。
5. 加完 MTT 反应 3-4 h 后,从培养箱取出 96 孔板的动作要轻柔,避免振荡结晶, 使其滑落. 你可以试着将 96 孔板倾斜 30 度角,然后用尖慢慢吸,有的细胞可以用排枪一起吸,有的则要耐心的一个个用头吸,尖的力度和方向要保证每个孔都一致。不要让头接触到孔底,且一旦倾斜孔板后就不要反复倾斜放平,这样也会使结晶脱落。
6. 用医用的注射器加上针头吸取液体的,吸取时要把板子斜放,沿着壁吸取就好了!这次 MTT 我用 1 ml 针头仔细吸培养液, 觉得比其它方法可靠, 一般不会吸走紫色结晶.
避免清除上清而改进的方法
由于一般可离心 96 孔板的离心机不好找。既使是贴壁细胞做 MTT 时,用 DMSO 溶解得到结果也不好,不是得不到预期结果就是可重复性差。
解决方法 1: 用以下文献方法:周建军等,评价抗癌物质活性的改良 MTT 方法,中国医药工业杂志,1993,24(10):455 - 457
具体方法:
配三联溶解液:10%SDS,5% 异丁醇,0.012mol/LHCL,蒸馏水溶解。
三联溶解液:SDS10 g,异丁醇 5 ml,10M HCl 0.1 ml 用双蒸水溶解配成 100 ml 溶液
优点:简化操作,提高了可靠性。
解决方法 2:日本同仁有一种新试剂 CCK- 8 试剂, CCK- 8 试剂可用于简便而准确的细胞增殖和毒性分析。其基本原理为:该试剂中含有 WST–8[其化学名称为:2 -(2 -甲氧基- 4 -硝基苯基)- 3 -(4 -硝基苯基)- 5 -(2,4 -二磺酸苯)- 2 H-四唑单钠盐],它在电子载体 1 -甲氧基- 5 -甲基吩嗪 硫酸二甲酯(1 -Methoxy PMS)的作用下被细胞线粒体中的脱氢酶还原为具有高度水溶性的黄色甲 染料(Formazan dye)。生成的甲 物的数量与活细胞的数量成正比,因此可利用这一特性直接进行细胞增殖和毒性分析。CCK- 8 试剂中已预先配入了进行细胞增殖和毒性分析所需的成分,无需再用缓冲液或培养基进行稀释;同时,CCK- 8 试剂无需任何放射性同位素和有机溶剂。因此,无需特别的技巧,就可使每一位使用者准确、快速地得到重现性好的实验结果。
★优 点
1、简 便 只需一步即可得到结果
2、省 时 毋需预制,即开即用
3、安 全 毋需放射性同位素和有机溶剂
4、快 速 省去了溶解除沉操作
5、灵敏度高 灵敏度高于 MTT
6、重现性好 步骤少;无损失;结果准确
就是比较贵,如果经费充足,用这个是不错的。
★进行细胞增殖分析的使用方法:
1、接种细胞悬液 100μl 于 96 孔板内,预先置于 37℃,5% CO 2 饱和湿度培养箱内培养。
2、在每个孔内加入 10μl 的 CCK- 8 试剂。
3、把培养板放在培养箱内培养 1 - 4 小时。
4、在 450nm 波长处测定吸光度,参比波长为 600nm 或 600nm 以上。
解决方法 3:使用 MTS
解决方法 4:加入 DMSO
在同一批实验中最好不要更换 DMSO。加 DMSO 前把孔中液体尽量弃干净,没有去掉上清直接加 DMSO,一是沉淀会很难溶解. 二培养液的颜色在检测时也能被测到, 会对最后结果造成影响。但前提是不能把细胞也一起吸掉,因为这样带来的误差要远远大于培养液没弃干净带来的误差, 所以要在保证细胞不被吸掉的前提下,尽量把培养液吸掉。如果培养液没弃干净,空白孔也要留有等量的培养液,这样在检测时可以尽量去除培养液的影响,DMSO 的量也可为 100ul 或 150ul.
1. 加了 DMSO 后用振荡器轻轻振荡 5-10 min, 时间控制尽量严格一点, 放置时间长了会影响结果, 值会偏大, 且结果不可信.
2. 加入 DMSO 后可用排枪反复抽吸助溶,溶解后尽快检测。如果实验孔不多,建议用此法,因其比振荡溶解效果好。
3. 或放入 37 度放孵箱 15 分钟溶解结晶。
振荡是为了让甲臜溶解,这样才能更好的测量吸光度,振荡 96 孔板有专的振荡器,目的: 扎破气泡. 有气泡存在时, 由于其对光的反射与折射作用 (酶标仪的原理是通过测定特定波长透过样品的吸光度推测样品内特定物质的浓度), 会导致结果偏移.
OD 值的测定
至于测定波长的选择是因显色溶液而异的,对于 DMSO,溶解后呈紫(红)色,490nm 有最大吸收值, 而 ATCC 公司的 MTT 试剂盒用的不是 DMSO,它的测定波长是 570。(就如 ELISA 实验选用 OPD 作底物测定波长是 492,选用 TMB 显色液则用 450); 而对于 SDS 和酸化异丙醇,则选用 570nm,并且建议以 655nm 作为参考波长。
DMSO 溶后 10 分钟内测,越放颜色越深,而SDS做为溶解液测吸收光值,其值可在三天内保持不变.
细胞密度偏大测出的吸光度也会偏大,细胞密度小吸光度也会偏小;另外跟细胞状态也有关系,细胞状态不好的话,吸光度值也会低的;细胞数目少,或者是培养的时间短,OD 值也会偏低。如果各个孔的孔间差异性特别明显的话说明有可能存在污染, 空白孔的 OD 值太高,很可能是细菌污染。
复孔直接的 OD 值差别一般应在 0.1-0.15,差别太大考虑:1. 接种细胞数不均匀,或是接种太多,应保证每孔一致,一般是每孔 1000-10000 个。可以细胞细胞计数后,加入细胞悬液,再补培养基到预定体积,并轻轻吹打几次,使细胞均匀分布,这样比直接加入预定体积的细胞悬液要好,接种时应加含血清培养基。2. 贴壁时间:18-24 h,如果不够,未悬浮的细胞会被吸掉。
一般为了实验的准确,每个浓度可以设 5-6 个复孔,可以最后统计时,可以除去一个最高值和一个最低值,或者除去其中数据离谱的值,这些离谱数字的出现与细胞是否污染,细胞是否在培养期间死去,是否培养液蒸发过多,加 MTT 液是否准确,在 37℃,5% 二氧化碳培养箱中孵育时间是否一定(1-4 小时)等有密切的关系,当然测定 OD 值的仪器工作状态是否正常也非常重要!(一般开机预热 20 min)。
MTT 方法的吸收度在 0.2~0.8 之间误差较小。这和分析化学中的lambert-beer 定律有关, 对朗伯-比尔定律的偏离在吸光光度分析中,经常出现标准曲线不呈直线的情况,特别是当吸光物质浓度较高时,明显地看到通过原点向浓度轴弯曲的现象(吸光度轴弯曲)。这种情况称为偏离朗伯-比尔定律。若在曲线弯曲部分进行定量,将会引起较大的误差。在吸光光度分析中,仪器测量不准确也是误差的主要来源。任何光度计都有一定的测量误差。这些误差可能来源于光源不稳定,实验条件偶然变动,读数不准确等。
在光度计中,透射比的标尺刻度均匀。吸光度标尺刻度不均匀。对于同一仪器,读数的波动对透射比为一定值;而对吸光度读数波动则不再为定值。吸光度越大,读数波动所引起的吸光度误差也越大透射比很小或很大时,浓度测量误差都较大,即光度测量最好选吸光度读数在刻度尺的中间而不落两端。待测溶液的透射比 T 在 15%~65% 之间,或使吸光度 A 在 0.2~0.8 之间,才能保证测量的相对误差较小。当 A = 0.434(或透射比 T = 36.8%) 时,测量的相对误差最小。
其它的声音:
1. 最好用 570nm 波长的滤光片,因为 MTT 在这个波长的吸光度是峰值,换句话说灵敏度高。用其它波长的也有,一般是 490nm,但我的经验灵敏度降低一半。
2. 我们用的 BIO-TEK 公司的 ELx800, 一般值在 2 以下都是可靠的, 如果复孔之间值相差太大就要考虑是否是实验过程中的误差. 我曾经看到园子的有些帖子报道说 OD 值大概在 0.2 - 1.2 范围内与活细胞数有较好的线性关系,但 OD 值在 0.3 - 0.9 范围内可能更佳,若你的 OD 值不在这个范围内则你实验的细胞数可能不太合适,应调整你的细胞数。
边缘效应
96 孔板四周一圈的孔一般只做空白,不养细胞,否则这四行的数据会偏高或偏低,96 孔板在培养箱中,由于湿度不够,而培养箱由于具有一定的温度,由于温度梯度使得边缘的孔水分蒸发较快,导致培养基中各种成分浓度变化增大,导致细胞状态不同。对于这种现象,要保证培养箱中的湿度,减少开关培养箱的次数和时间。解决方法: 将孔板周围的一圈孔全部不用,影响非常大,而且最外一圈一定要加水、PBS 或者培养液,只要能防止蒸发就可以.
关于如何计算 IC50
(1) 改良寇式法:lgIC50 = Xm-I(P-(3 -Pm-Pn)/ 4)
Xm:lg 最大剂量
I:lg(最大剂量/相临剂量)
P: 阳性反应率之和
Pm: 最大阳性反应率
Pn: 最小阳性反应率
举个例子:各组浓度 0.1、0.01、0.001、0.0001、0.00001、0.000001,稀释倍数为 10,最大浓度为 0.1,抑制率为 0.95、 0.80、0.65、0.43、0.21,0.06。代入
计算公式:
Pm = 0.95
Pn = 0.06
P = 0.95 + 0.80 + 0.65 + 0.43 + 0.21 + 0.06 = 3.1
Xm = lg0.1 =- 1
lgI = lg0.1 / 0.01 = 1
lgIC50 =- 1 - 1 *(3.1 -(3 - 0.95 - 0.06)/ 4)=- 3.6025
IC50 = 0.00025
(2)Bliss 法: 自己查阅书籍
(3)IC50 计算软件,见下面附件
(4)自己用 EXCEL 做趋势线来求 IC50,关于 LD50 的方法与此相似!
(5)在线求 IC50 或 EC50:http://chiryo.phar.nagoya-cu.ac.jp/javastat/JavaStat-j.htm
结果统计学处理
所有数值以 x±s 表示,应用 SPSS 软件进行方差分析,p<0.05 时为相差显著,p<0.01 时为相差非常显著。可以以时间为横轴,光吸收值为纵轴绘制细胞生线,专门公式求 IC50。或计算抑制率。细胞死亡率%= OD 对照组-OD 实验组/OD 对照组
excel 表中可以做两两比较的 T-test, 这个你可以参考一下;你的数据应该用多个样本均数的 T-test,方差分析也可。用的软件是 SPSS 或者 SAS。
孔板的重复利用:
培养板要用好的(最好进口板),不好的板或重复利用的板只可做预实验。一般贴壁生长的细胞用重复利用的培养板效果不是很好,因为培养板表层在生产时涂有一层促进细胞贴壁的物质,在清洗后多半会失去。悬浮或是半悬浮生长的细胞还可以。建议不要用太多次,即使是进口的板子使用次数也不要超过 3 次, 底值最好在测得值的 1 / 3 一下。
强烈建议培养板不要重复使用:1、泡酸是可以,但是泡完酸的板子很不利于细胞的生长,会出现帖壁不好,细胞生长缓慢等情况.2、这样的板子消毒灭菌很不彻底,如果有万一, 则因小失大.3、重复用的板子洗不干净在培养过程中易出现杂质.
重复利用时
做法 1:
洗净后用 2%NaoH 浸泡 4 小时,再用 1% 稀盐酸浸泡 4 小时,冲洗 15 遍,蒸馏水冲洗 3 遍,烘干,UV 照射过夜 (紫外 2 小时以上消毒即可)
做法 2:
泡酸 2-4 小时,老师让我们别超过 4 小时,(普通的玻璃仪器是过夜)。捞出,冲洗干净,烘干后,UV 照射过夜。估计跟其他收集在一起,钴 60 照射消毒.
做法 3:
1. 做完MTT后用大水流尽量将板冲净,然后用洗衣粉水泡几个小时(小心最好让洗衣粉先化开)。2. 用自来水冲净洗衣粉水,倒扣晾干.3. 重铬酸钾加浓硫酸配成的酸液中浸泡过夜泡洗液 (六小时以上即可) 后自来水洗净(20 次左右)每个孔都要处理 4. 用去离子水冲洗 3 遍,双蒸水冲洗 3 遍,烤干 5. 超净台中紫外线照射 2 个小时左右,就可以用了,不可以高压。
做法 4:
1、测完值的 96 孔板甩掉孔内培养液,放入超声中超 10 - 30 分钟,晾干 (或烘干) 备用。
此步骤可最大程度的洗去污垢及细胞。
2、每孔加入 50 - 100ul 的胰酶 (0.05%),我一般加 60ul,加完胰酶后水平振荡 96 孔板以使胰酶均匀覆盖于细胞表面,室温下放置至细胞被消化脱落为止。假如你想消化快一点的话可将 96 孔板放到 37 度培养箱内 (胰酶在 37 度时的活力最大)。
对于顽固贴附在壁上的细胞,此步骤最为有效。
3、甩掉胰酶,自来水下冲洗,晾干 (或烘干) 备用。
如果不烘干就泡酸,那么 96 孔板残留的水分将稀释酸液,长期以往泡酸的效果下降。
4、将晾干的 96 孔板泡酸 (中强酸) 过夜,捞起后自来水下冲洗 10 遍;双蒸水冲洗 3 遍。三蒸水冲洗 3 遍。烘干备用。泡酸时特别注意时间不要太长了,否则板子变黄,影响最后的 OD 值的测定。
5、做实验前,96 孔板至少在紫外灯下照射 30 分钟,但不能长期照射。紫外线长期照射可使板变黄,我的两块板放在超静台上忘了拿出来,一直照了两个星期,等我从超静台上取出板已经变成黄色。
注:
1、在实验中若你测得某一个孔的数值偏高,虽然有很多因素会导致数值偏高,但是如果是板底的污点引起的话你可以消除。拿出 96 孔板擦一擦值偏大孔的板底部,再测值。你会发现孔高的值又会到正常水平。因为咱们做实验时手不可避免的接触 96 孔板板底留下痕迹,这些痕迹就会使吸光度升高。
2、96 孔板洗的次数多了,板底自然留下划痕,这就会导致读数的不均而影响实验结果。你不妨在做实验前测一次 96 孔板的值 (此值为初值),实验测得的为后值。后值减去初值就接近实验的真实值。
文章来源:丁香园@ftfsunny