肠菌也有敌友识别系统?Nature 揭示人类肠道细菌含有获得性细菌间防御系统
人的肠道居住着密集多样的微生物群落,肠道微生物组承担着各种角色,如帮助消化食物、提供营养物质如维生素、抵御有害细菌等,其组成变化与人体健康息息相关。
尽管近些年肠道微生物组学的研究一直是热点,但因其有着极其复杂的作用机制,我们对它的了解还是太少。
饮食和宿主免疫力等外在因素不足以解释肠道微生物群落的组成,目前认为共存肠道微生物之间的直接相互作用是微生物组成的重要驱动力。
现有的许多肠道细菌治疗方法到底是否具有普适性,吃益生菌到底是否可以改善肠道菌群,通过操纵肠道微生物来促进人类的健康是否有望成为可能?
既然肠道微生物对人体有那么重要的影响,那么吃点有益菌,或者多喝点酸奶,是不是可以改善肠菌的组成和功能呢?
Nature 的最新研究《Human gut bacteria contain acquired interbacterial defence systems》表明,肠道内的微生物不仅会释放各种毒素杀死对手,还会相互传递防御系统,因此新来的细菌若要定居下来,需要在严苛的军备竞赛中胜出。
也就是说虽然通过调节肠道微生物来促进健康是有可能的,但是绝对没有我们想象的那么容易,每个人的肠道菌群都有一套独特的生存法则,我们要先弄清楚细菌在每个人肠道定殖的规则,才有可能通过操纵和调节肠道微生物进而促进人体的健康。

图片来源:Nature
主要内容
1. 人体肠道微生物组中的脆弱芽孢杆菌 T6SS 免疫
VI 型分泌系统(T6SSs)是革兰氏阴性细菌中许多成员最常用来抑制其它细菌或真核微生物的接触依赖性拮抗(抑制)系统,可以将毒性效应蛋白投放到相邻细胞将其杀死。
尽管亲缘关系相近的微生物可以通过同源免疫蛋白对这些效应子具有天生的抵抗力,但尚不清楚肠道中的其它微生物能否逃脱中毒。
为了确定对人体肠道 T6SS 赋予细菌间效应防御的潜在机制,作者收集来自健康成年人肠道微生物组的宏基因组数据,并对微生物组样本中基因和物种丰度进行分析,挖掘同源性免疫功能基因序列。
发现在某些样本中,检测到的脆弱芽孢杆菌T6SS 免疫基因的丰度明显高于(十倍以上)预测的脆弱芽孢杆菌的丰度。
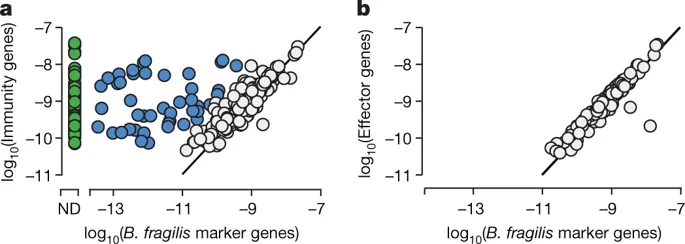
在人类肠道微生物中发现了超乎想象广泛存在的T6SS免疫基因。
图片来源:Nature
2.免疫基因由多个物种编码
进一步研究发现,在检测不到脆弱拟杆菌物种存在的样品也检测到脆弱拟杆菌免疫基因的同系物,这表明,这些元件可以由在肠道其它细菌包括卵圆拟杆菌(B. ovatus)、普通拟杆菌(B. vulgatus)、溃疡拟杆菌(B. helcogenes)等编码。
为了确定这些细菌是否也可以解释人类肠道微生物组中免疫基因的存在,作者从各个微生物组的宏基因组测序读取物中组装了全长预测的免疫基因。这些免疫基因序列与现有脆弱芽孢杆菌基因组的比较显示进化枝高度同源匹配。
作者作出假设,其它肠道微生物「拿」走了脆弱拟杆菌的基因,共享其防御系统,以此抵挡其它竞争对手,并在肠道生境中发挥适应性作用。
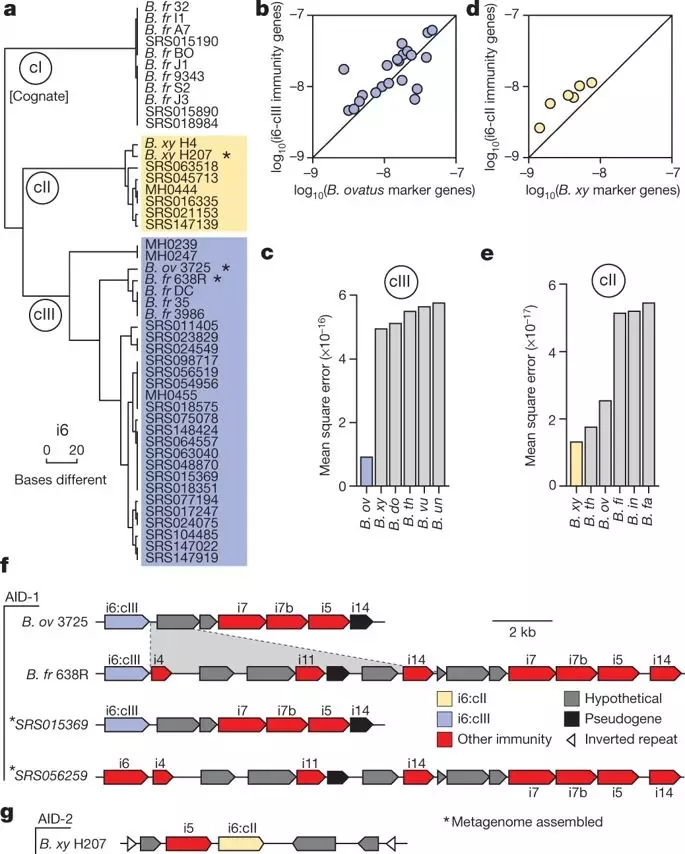
人类肠道微生物组编码的T6SS免疫基因簇的层次聚类及不同类群中免疫基因丰度的比较。
图片来源:Nature
3. AID 系统免疫基因和 T6SS 毒素
脆弱芽孢杆菌T6SS 免疫基因 i6 和 i7 的同源基因被称为 AID-1(获得性细菌防御 1)系统。作者发现在基因组上 AID-1 与移动整合和共轭元件(ICE)邻近,而 ICE 正是横向基因转移事件存在的标志之一。
为了测试这些基因是否可以在菌株之间转移,作者使用脆弱芽孢杆菌 B. gilgilis 638R 作为供体,B. gilgilis 43859 作为受体进行了基因转移研究。
结果发现获得 AID-1 对脆弱类芽孢杆菌 43859 产生了明显的保护作用,可以防御预先定殖在无菌小鼠中脆弱芽孢杆菌 9343 的 T6SS 介导杀伤作用。
为衡量这些防御因素对肠道竞争力的影响,作者比较了人类肠道宏基因组样本中有和没有免疫基因的卵形芽孢杆菌的丰度,发现具有免疫基因的卵形芽孢杆菌菌株的丰度大大超过了没有免疫基因的菌株。
这些发现表明,将免疫基因转移到其它微生物中,足以提供防御 T6SS 效应子的能力。
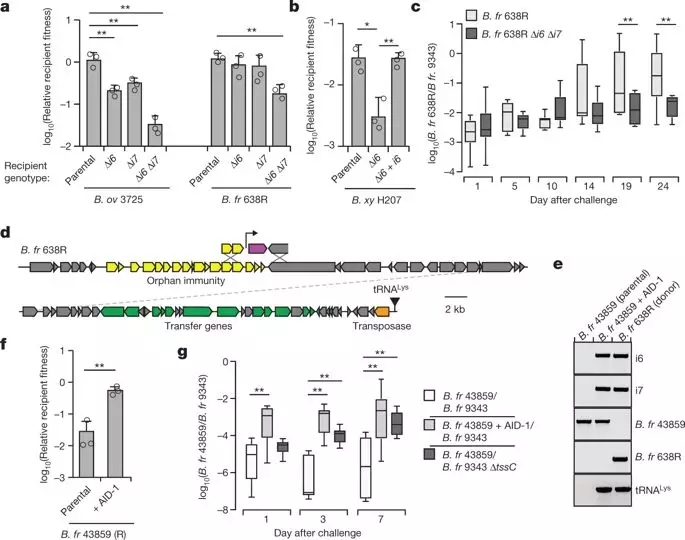
免疫基因是可移动的,可以抵抗T6SS转运蛋白的毒素。
图片来源:Nature
亮点分析
通过操纵肠道微生物来促进健康的方式很有潜力,但目前我们还没有完全清楚这些肠道微生物的生存规则。越来越多的证据表明,在许多环境中微生物之间的竞争作用占主导地位。
1. 作者通过大数据挖掘以及实验验证发现,人类粪便样品具有毒素和免疫基因的独特组合,以及拮抗选择压力可能是导致不同通路的免疫基因广泛传播的主要原因。
2. 作者通过模型预测表明,细菌间的拮抗作用是维持稳定肠道群落的关键因素,而 T6SS 效应子多样化和扩展会可能导致肠道微生物之间的军备竞赛。
由此得出推论,通过简单摄入益生菌可能不会改变肠道菌群,益生菌可能缺乏如针对 T6SS 系统的免疫基因而被肠道土著菌群抑制。同时,这项研究也迈出了为不同的人展开个性化分析来改善肠道菌群的重要一步。








