Diabetes | 华科黄昆 / 武大郑凌团队揭示甲基化结合蛋白可调控脂肪细胞棕色化控制食物诱导的肥胖
随着生活水平的提高,肥胖已经成为一种常见的疾病。能量摄入过多,会出现脂肪组织过度及积累,严重威胁人类健康。减肥主要是将脂肪组织燃烧,增加白色脂肪细胞的棕色化,产生能量。
2019 年 10 月 9 日华中科技大学同济医学院药学院黄昆教授与武汉大学细胞内稳态国家重点实验室郑凌教授合作报导发现:脂肪特异性敲除甲基化 CpG 岛结合蛋白 2(Mecp2)会上调分泌型白细胞蛋白酶抑制因子(Slpi),通过增加脂肪棕色化减少肥胖,结果发表在 Diabetes 上,题为《Fat-Specific Knockout of Mecp2 Upregulates Slpi to Reduce Obesity by Enhancing Browning》。
该研究揭示了甲基化 CpG 岛结合蛋白一种非神经性功能机制,为肥胖和代谢紊乱提供新的潜在治疗靶标。
黄昆教授主要从事代谢疾病机理及相关创新药物研究,有着长期综合利用多种生物学手段研究疾病病变机理及相关治疗药物的经历。
郑凌教授主要研究糖尿病及其并发症,神经退行性疾病相关内容。

图片来源:Diabetes
具体内容
作者首先分析了肥胖人群和高脂料饲养小鼠体内 Mecp2 的表达上调,在血管基质(SVF)细胞和 3T3-L1 向脂肪细胞分化过程中,Mecp2 表达上调。
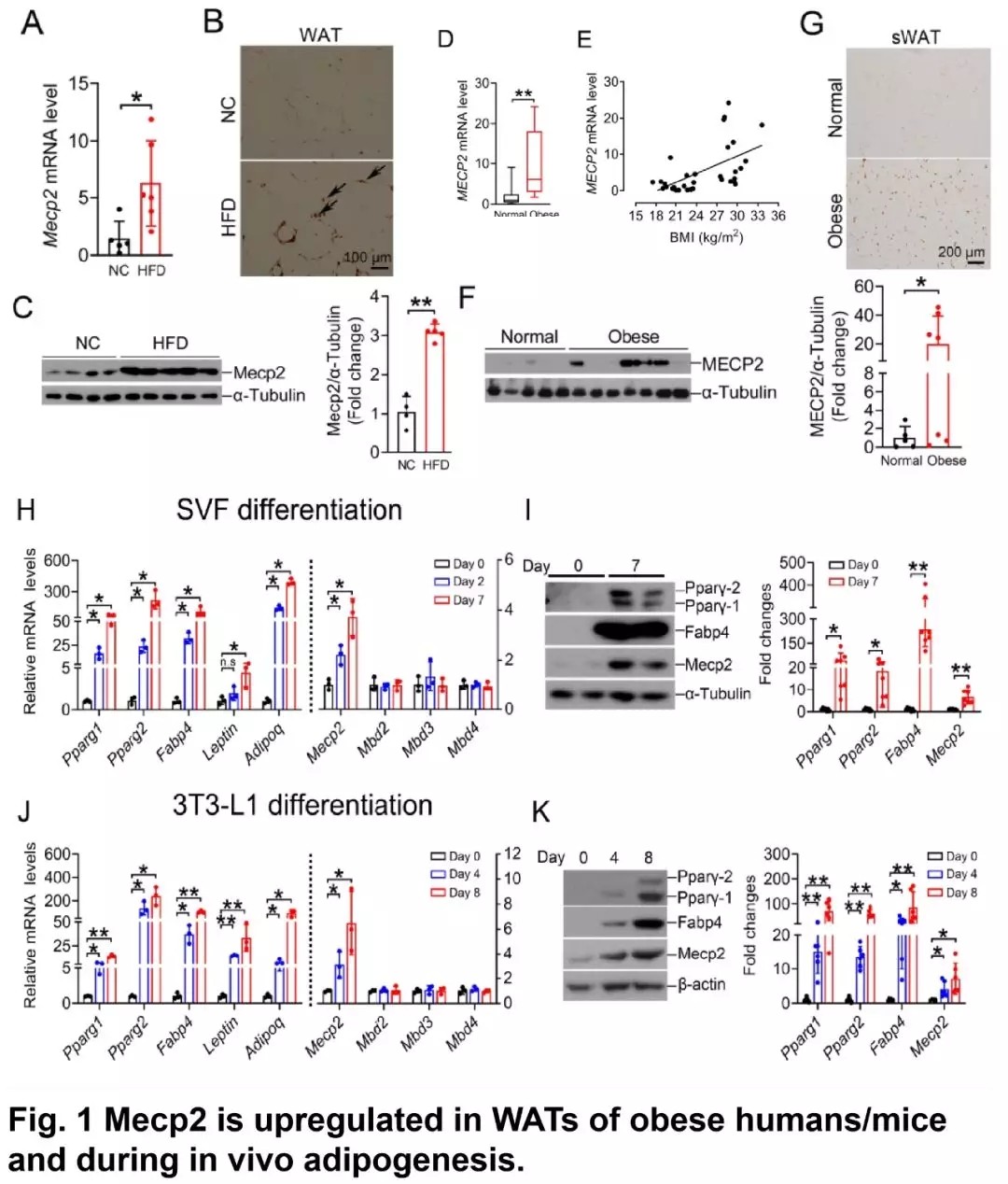
图片来源:Diabetes
接着作者利用 loxP/Cre 系统建立了脂肪组织特异性敲除 Mecp2 小鼠,用正常饲料喂养发现 Mecp2 敲除小鼠出现纤瘦表型,体重减轻,脂肪量减少,肝重减小,耗氧量增加,脂肪细胞变小;血清中瘦素、胰岛素、甘油三酯、胆固醇和葡萄糖含量没有显著变化,采食量和对葡萄糖耐受没有显著变化;心脏、肾脏、脾脏重量没有显著变化。
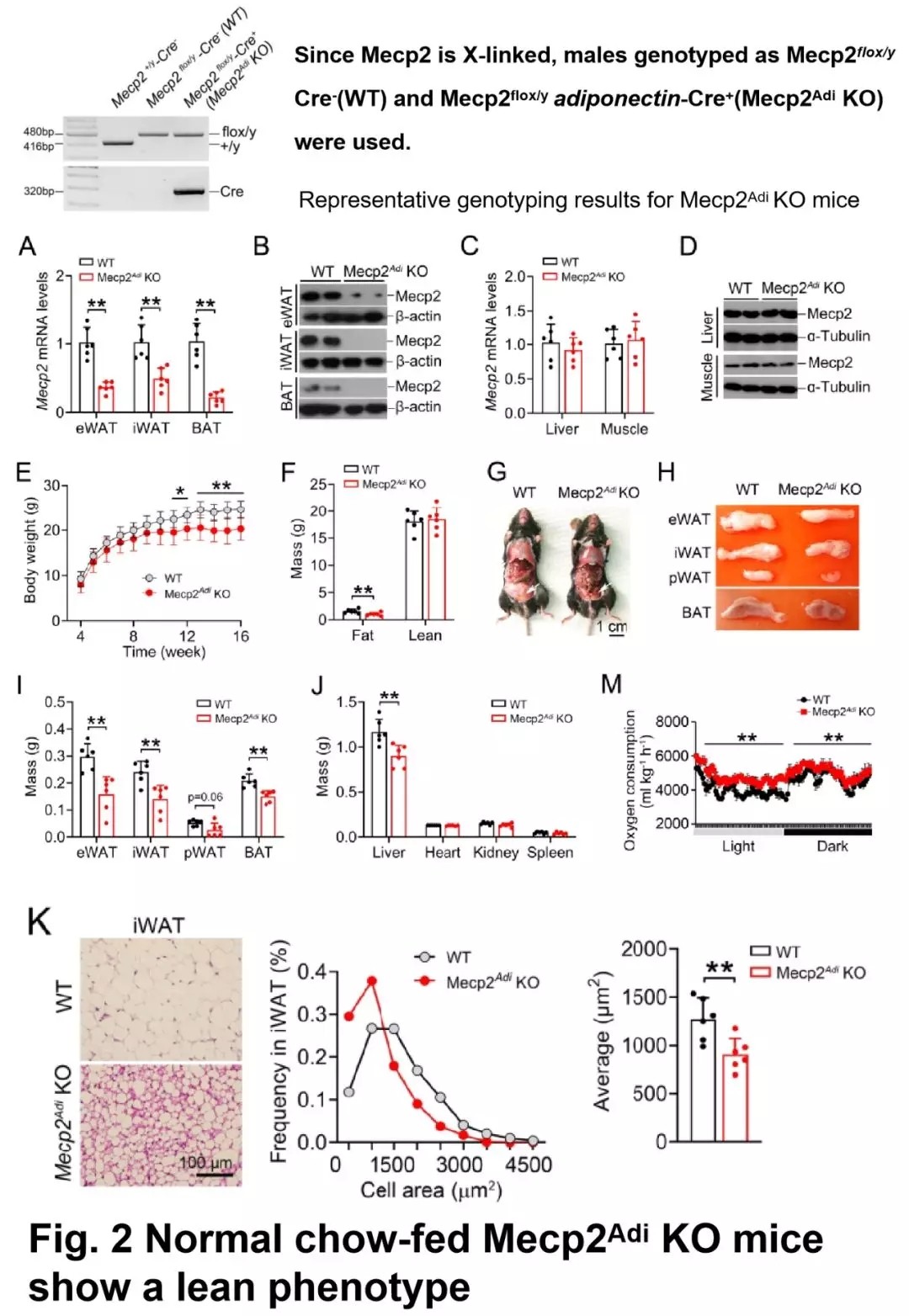
图片来源:Diabetes
然后作者对股骨沟脂肪和棕色脂肪进行转录组测序,发现产热基因表达上调,脂肪生成基因表达下调,并用 real-time PCR、Western blot 和免疫组化对转录组测序数据进行验证。
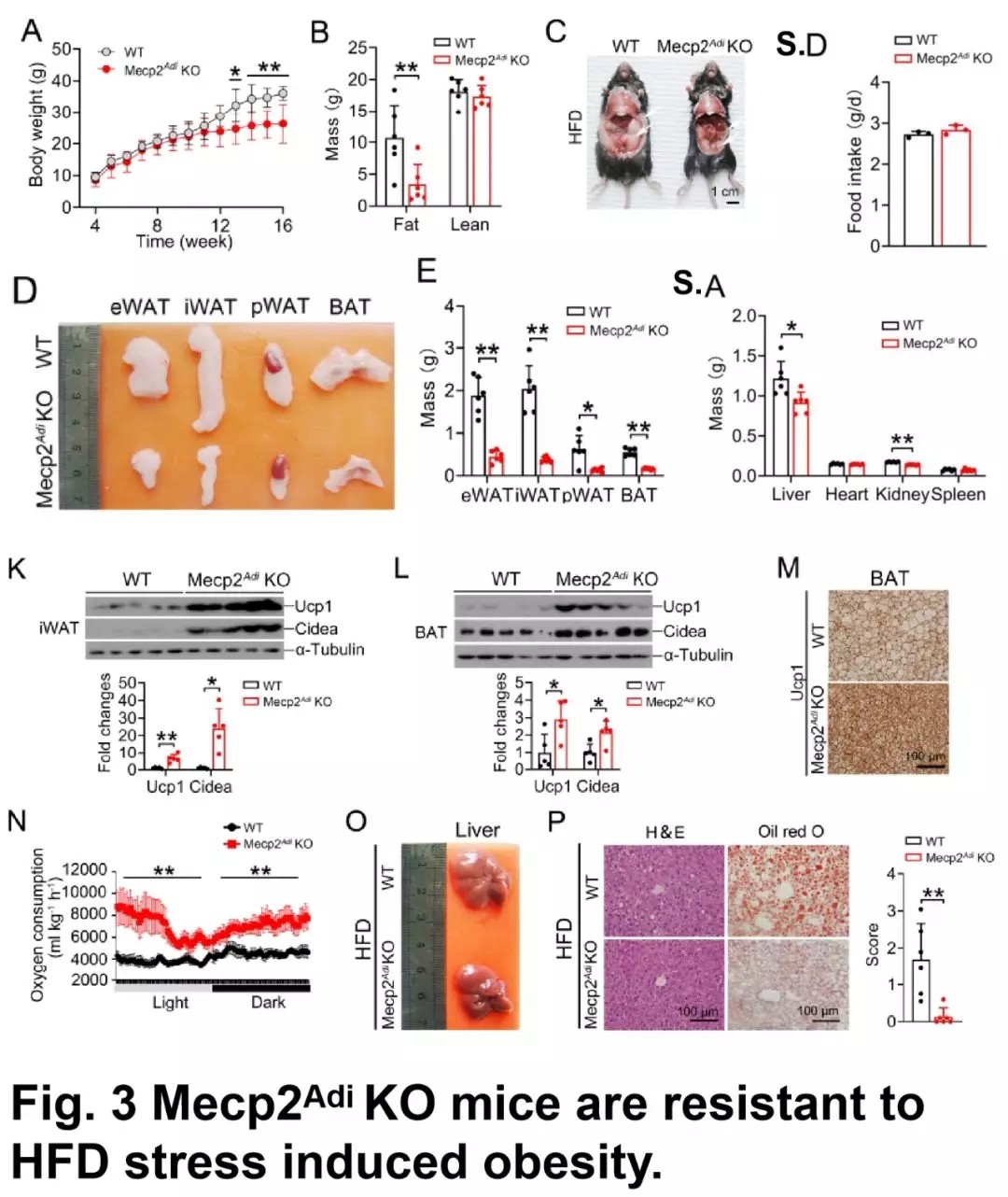
用高脂料喂养小鼠,发现在 Mecp2 组中,小鼠的肥胖程度减弱,体重、脂肪量减弱,脂肪细胞变小;对葡萄糖和胰岛素的抵抗能力减弱;血清中瘦素、胰岛素、甘油三酯、葡萄糖含量降低,胆固醇含量升高;脂肪生成基因下调,产热基因上调;耗氧量增强;肝脏、肾脏重量减小,脂肪肝病变指数降低;但采食量、心脏、脾脏重量没有显著性变化。
这部分试验说明 Mecp2 敲除小鼠对高脂料诱导的肥胖现象有抵抗作用。
通过在 Mecp2 敲除型老鼠的血管基质细胞和 3T3-L1 细胞系干扰 Mecp2 后,向脂肪诱导分化试验中发现,Mecp2 可促进脂肪分化。
图片来源:Diabetes
接下来作者在小鼠腹腔注射 CL316,243(β- 去甲肾上腺素,β3 - 肾上腺素受体激动剂,刺激产热),冷刺激(4℃)和热中性刺激(30℃)下,Mecp2 敲除型小鼠的产热基因均表现出较高的表达水平,脂肪细胞加剧棕色化。炎症性细胞因子的表达不存在显著性变化。
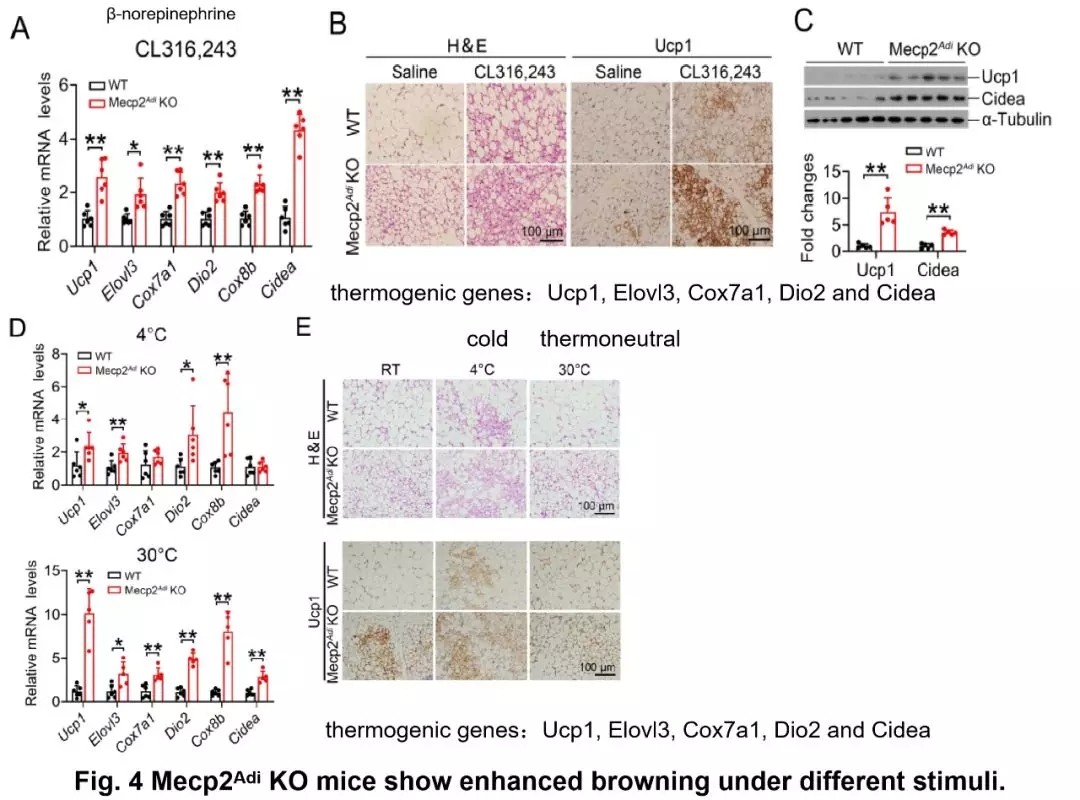
图片来源:Diabetes
由此作者产生疑问,Mecp2 发挥作用的分子机理是什么?
通过对比转录组测序数据发现 Slpi 处于 Mecp2 敲除组的极显著位置。
免疫组化 Slpi 的表达量在高脂饲喂小鼠和肥胖型人的脂肪组织中表达较低,在 Mecp2 敲除小鼠的腹股骨沟脂肪细胞中表达较高,正好与 Mecp2 的表达呈负相关关系,同样在敲除 Mecp2 小鼠的血管基质细胞中、脂肪细胞中得到验证。
在冷热刺激下,β- 去甲肾上腺素刺激下 Slpi 的表达量均与 Mecp2 的表达呈负相关。在 3T3-L1 细胞分化过程中,Slpi 的表达量受 Mecp2 剂量依赖方式负调控。
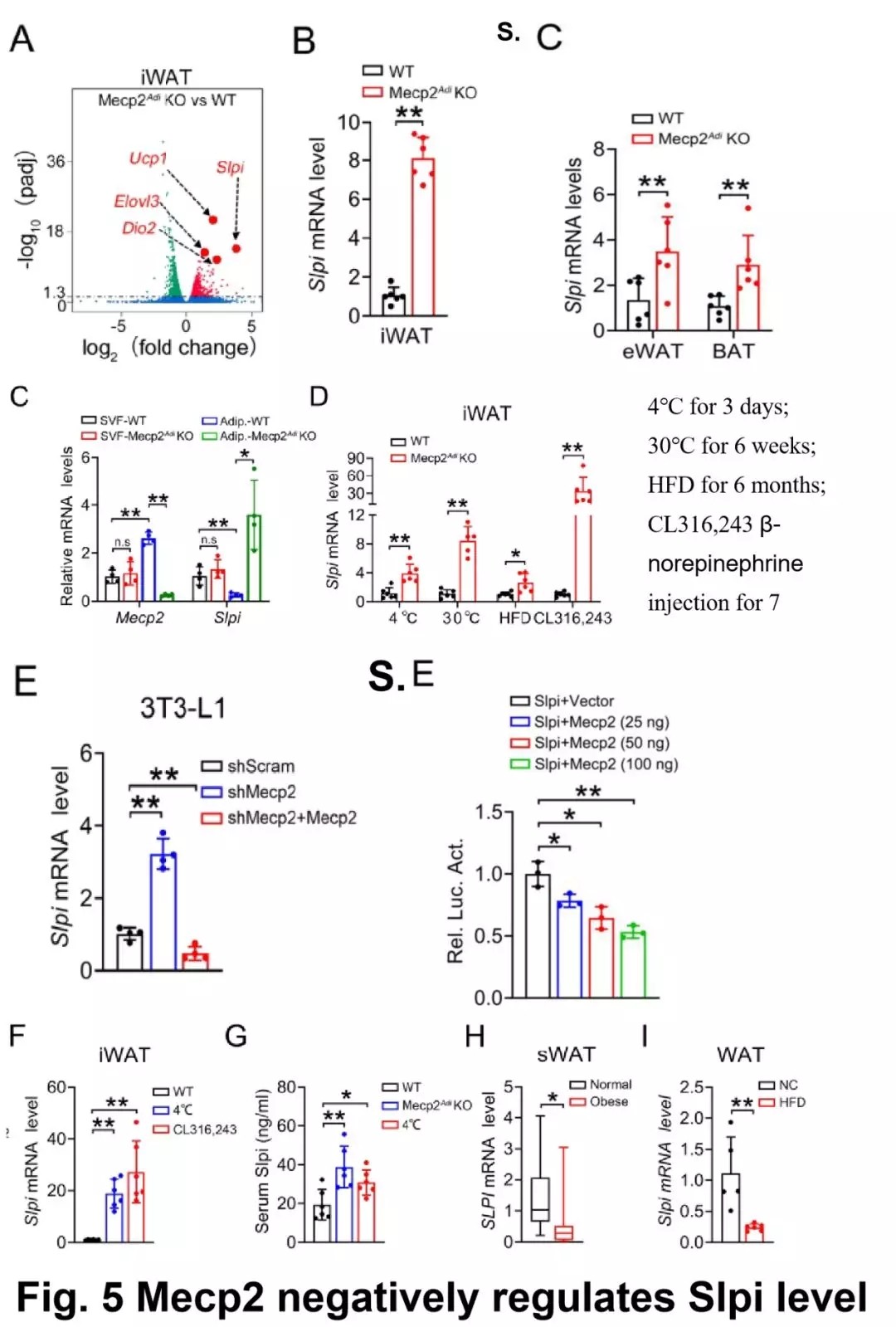
图片来源:Diabetes
对于 Mecp2 怎么调控 Slpi,作者进行了 co-IP 和 ChIP-qPCR 试验,发现 Mecp2 可以结合核受体共阻遏因子(NcoR1)、Slpi 和 Ucp1 基因启动子上。
Mecp2 敲除小鼠中 Slpi 和 Ucp1 启动子上 Mecp2 结合率较低,主要是体内 Mecp2 的表达量较低;在冷、热、β- 去甲肾上腺素刺激正常小鼠后,机体脂肪细胞棕色化加剧,是因为 Slpi 和 Ucp1 的表达量要增多,进而得出二者的负调控因子 Mecp2 较少地结合到各自启动子上(详见正文)。
对于 Mecp2 可以调控 Slpi 表达进而影响脂肪细胞棕色化的机理探讨中,作者还进行了体内试验。
用正常饲料饲喂敲除型和野生型小鼠,再在腹股沟脂肪垫内多位点注射腺病毒包被的 Slpi 干扰载体(PAAV-shSlpi/Scram),之后在第 21 天时,进行冷刺激试验,发现腹股沟脂肪内和血清中 Slpi 的表达量显著降低,证明 Slpi 的干扰效果显著。
并且腹股沟脂肪重量、免疫因子表达没有收到显著改变。但在 Mecp2 敲除型小鼠的脂肪细胞中,Slpi 的敲低可降低细胞棕色化,降低产热基因表达量。
回溯比较发现野生型 Mecp2 的表达量没有显著变化。说明敲低 Slpi 可以抑制脂肪细胞棕色化,Mecp2 可以负调控 Slpi 的表达进而抑制脂肪细胞棕色化。
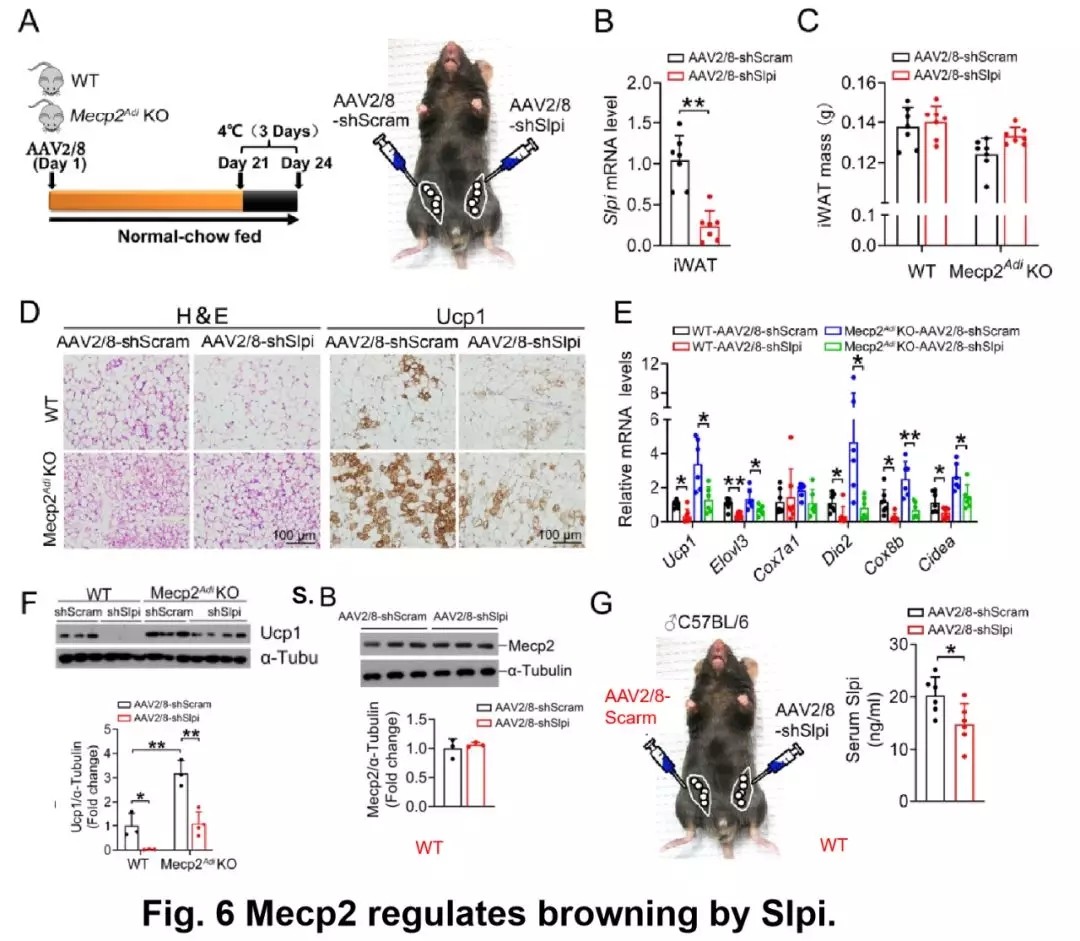
图片来源:Diabetes
做了在正常饲料饲喂条件下 Slpi 干扰试验,发现 Mecp2 可以负调控 Slpi 的表达进而抑制棕色化,那么在高脂料饲喂条件下,Slpi 的过表达试验是否也说明这一问题呢?
作者在高脂料饲喂野生型小鼠试验中,在第 14 天腹腔注射人重组 Slpi 蛋白,发现血清中 Slpi 的含量显著上升,证明 Slpi 的过表达效果显著。
小鼠体重减小,脂肪细胞重量、肝脏重量减小;产热基因的表达水平显著上调;脂肪肝指数显著降低;但棕色脂肪重量、小鼠的采食量和炎症细胞因子的表达量没有显著变化。
说明过表达 Slpi 会显著提高白色脂肪向棕色脂肪的转化,增加产热,抑制日粮诱导产生的肥胖。
在体外试验中,同样重组 Slpi 蛋白会挽救 Mecp2 过表达产生的产热基因的下调,促进米色脂肪的分化。
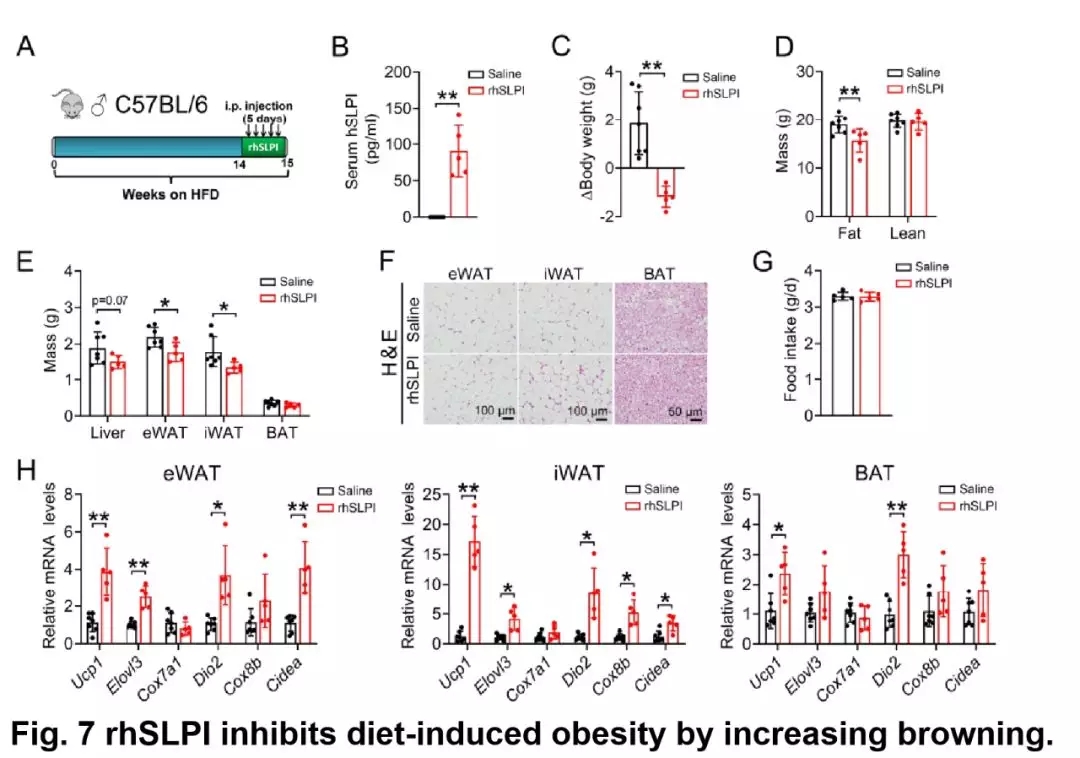
图片来源:Diabetes
延伸阅读
2011 年,《Novel anti-inflammatory role of SLPI in adipose tissue and its regulation by high fat diet》文章中,作者 Adapala,Venkata J 等人给 C57BL6 小鼠喂养高脂料和低脂料,通过 Western blot、ELISA 和 real-time PCR 的方法,发现 SPLI 在脂肪组织和脂肪细胞中特异性表达,在炎症反应中发挥重要作用。

图片来源:Journal of Inflammation
2019 年,《Expression of key genes involved in DNA methylation during invitro differentiation of porcine mesenchymal stem cells (MSCs) into adipocytes》文章中,作者 Stachecka,Joanna 等人发现猪的脂肪间充质干细胞和骨髓间充质干细胞向脂肪细胞分化过程中,全基因组甲基化程度升高,甲基化 CpG 岛结合区域蛋白(MBDs)也逐渐升高,指出在猪脂肪细胞分化过程中甲基化水平的动态变化。

图片来源:BBRC
小结
作者讨论提出脂肪特异性敲除甲基化 CpG 结合蛋白对刺激诱导下脂肪棕色化的敏感性原因有两个:
一是脂肪特异性敲除甲基化 CpG 结合蛋白小鼠体内的成熟脂肪细胞中,脂肪酸合成酶缺失,增加了腹股沟米色脂肪的能量产出,阻止了饮食诱导的肥胖;
二是脂肪特异性敲除甲基化 CpG 结合蛋白的腹股沟脂肪组织中,棕色化基因 Ucp1 启动子上甲基化 CpG 结合蛋白的结合量变少,造成 Ucp1 的表达升高。
在人脂肪组织分泌组中预测到了分泌型白细胞蛋白酶抑制因子(SLPI)。冷刺激或重组 SLP1 处理会引起血清中 SLPI 的表达升高,说明 SLP1 可被脂肪组织释放到血清中。
重组 SLP1 调控高脂诱导鼠的脂肪细胞棕色化,产热基因的表达,米色脂肪细胞的分化,说明 Slpi 可以通过自分泌和内分泌的方式发挥作用。
结果:作者报道了一种全新的,非中枢神经系统的,脂肪细胞中甲基化 CpG 结合蛋白会抑制脂肪细胞棕色化,通过调控脂肪因子 Slpi 实现。
这种甲基化 CpG 结合蛋白和分泌型白细胞蛋白酶抑制因子的功能研究为治疗肥胖和代谢紊乱提供了新的治疗靶标。
参考文献:
[1] Liu C, Wang J, Wei Y, et al. 2019, Fat-Specific Knockout of Mecp2 Upregulates Slpi to Reduce Obesity by Enhancing Browning. Diabetes.
PMID: 31597640; DOI:10.2337/db19-0502
[2] Adapala, Venkata J, et al. 2011. Novel anti-inflammatory role of SLPI in adipose tissue and its regulation by high fat diet. Journal of inflammation-london.
PubMed ID: 21356117; DOI: 10.1186/1476-9255-8-5
[3] Stachecka, Joanna, et al. 2019. Expression of key genes involved in DNA methylation during invitro differentiation of porcine mesenchymal stem cells (MSCs) into adipocytes. Biochemical and biophysical research communications.
PubMed ID: 31791576; DOI: 10.1016/j.bbrc.2019.11.175