人类肠道芯片为发现新的无线电防护药物提供了希望
我们要求模拟辐射损伤引起的戴尔死亡和对策药物反应的作者在人类肠道芯片上阐述他们最近在细胞死亡和疾病中发表的重要意义。在下面的采访中,哈佛大学怀斯研究所的主要作者萨桑·贾利利·菲鲁齐内扎德回答了我们的问题。
你能简单地解释一下你的结果吗?
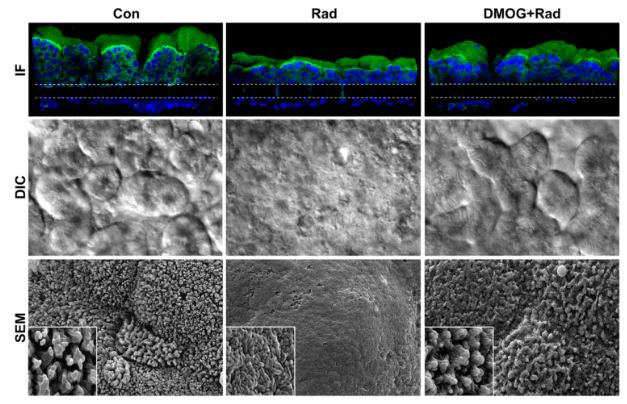
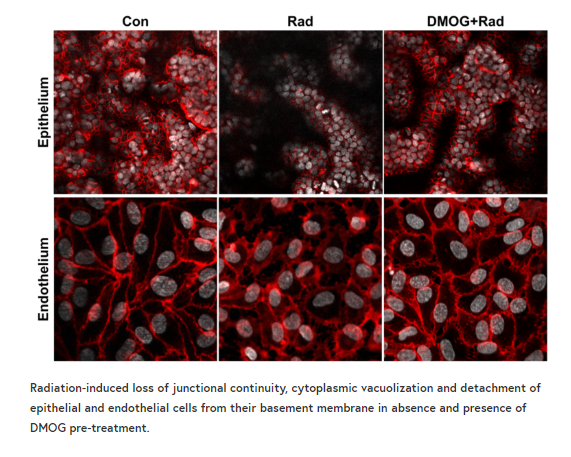
暴露于电离g辐射,无论是治疗性的还是意外的,都可能导致与胃肠道紊乱相关的急性辐射综合征。利用片上器官(organic-on-a-chip,organic-chip)微流控培养技术,我们建立了一种由人肠上皮细胞与血管内皮细胞连接的肠道模型,该模型模拟了辐射剂量为8格雷(Gy)时引起的肠道损伤,已知该损伤会对人体产生胃肠道效应。我们观察到内皮和上皮细胞损伤的一些标志物增加。其中包括细胞凋亡(或细胞死亡)、活性氧(ROS或自由基)的产生、双链DNA断裂、膜脂降解、微绒毛结构丧失,以及形成屏障的细胞-细胞连接被破坏,从而保护肠壁免受细菌和毒素的侵害。
利用肠道芯片辐射模型,我们证实了用一种潜在的辐射防护药物二甲基草酸甘氨酸(DMOG)进行治疗前,可显著降低肠上皮细胞的凋亡、肠通透性和微绒毛损伤,以及内皮和上皮细胞中的活性氧生成和脂质降解,结果是以前的实验模型从未演示过。
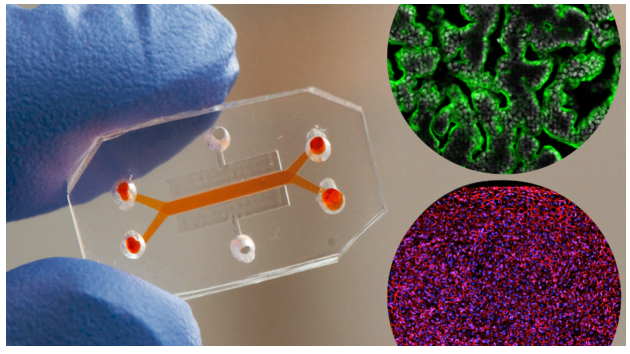
你能简单地解释一下肠道芯片是什么吗?为什么你的研究小组选择对它进行修改?
人体肠道芯片是一种微流控培养装置,由一种透明、柔韧的硅胶聚合物组成,其大小与电脑记忆棒差不多(见上图)。肠道芯片含有两条平行的通道,由一个多孔膜隔开;人肠上皮细胞在一个通道的膜顶部培养,人微血管内皮细胞在第二个通道的同一膜的对侧培养。培养基通过两个通道进行灌注,并定期对芯片内的侧腔进行抽吸,以模拟肠道的正常循环运动(蠕动)。在大约一周内,肠道芯片模拟了活肠的绒毛结构和多种功能。
与以往的辐射模型不同,我们将血管内皮细胞纳入肠芯片,因为最近的动物研究表明,这些细胞在辐射损伤中观察到的胃肠道损伤中起着关键作用。我们的结果证实了这一猜想:血管通道内皮细胞在ROS生成、脂质降解、DNA断裂和凋亡方面比上皮细胞表现出更强的辐射反应。有趣的是,当我们在没有内皮细胞的情况下重复芯片实验时,辐照后的肠细胞并没有表现出典型的辐射反应,这表明内皮细胞是辐射引起肠功能障碍的介质。
你的研究对治疗学开发人员、医生和病人有什么意义?
人们可能意外地(如核事故、太空飞行中的宇宙射线)或由于放射治疗而受到电离g辐射。这些意外暴露会导致癌症基因突变和死亡,虽然辐射疗法使用的剂量较低,但它们仍然会造成有害的累积副作用。由于将健康人暴露在辐射下进行临床试验是不道德的,因此确定能够减轻辐射影响的药物的努力仅限于动物研究,而动物研究是众所周知的对给定药物在人体中的行为的不良预测。然而,人体肠道芯片辐射模型为研究辐射损伤的机制提供了一个潜在的强大工具。该肠道芯片可用于未来发现和筛选新的更有效的抗肿瘤药物,以挽救癌症患者、宇航员或意外受到辐射的平民的生命。
根据你的研究结果,你认为未来的研究方向是什么?
当动物或人类暴露在导致严重伤害的全身辐射剂量下时,致死主要是由于胃肠道、肺和骨髓受损的综合作用。因此,我们也在利用这些器官的人体器官芯片模型来研究辐射损伤。此外,有证据表明,例如,肠道的辐射损伤可以影响同一个体的骨髓所遭受的损伤程度,其影响方式受肠道微生物组的存在影响。因此,我们开发了在我们的肠道芯片中培养包含人类肠道微生物群的复杂共生微生物群落的方法,这将使我们能够分析微生物群是如何促成这些反应的。
此外,我们还通过不同的人体器官芯片的内皮血管通道将其连接起来,以有效地创建一个“芯片上的人体”,该芯片可能被用于模拟这些器官-器官相互作用,从而介导人体对辐射的反应。为了开发个性化的体细胞芯片模型,我们还用从病人活检中分离出来的细胞制作了肠芯片,其他人已经证明,这也可以用病人来源的诱导多能干细胞(iPS)来完成。我们现在正在利用这些新的模型,结合生物信息学和计算发现方法来识别新的辐射对抗药物。