如何获得高质量的免疫荧光图 | 实验
丁香园
在免疫荧光染色过程中单染和共染是常用的两种方式,除此之外我们还可能会用到远红外进行染色标记。
这相对于前两者实验操作上处理方法是一致的,唯独在样品处理上有所不同,而导致荧光定位标记的颜色增多,相对而言变得复杂。
免疫荧光技术主要是通过抗体与一些示踪物质结合,利用抗原抗体反应进行组织或细胞内抗原物质的定位。
那么接下来,我们重点来介绍免疫荧光操作方法以及注意事项。
操作步骤:
1. 首先,在常温下将组织切片用免疫组化笔进行画圈,接着加入 0.1M PB 约 50 微升左右,进行每次 20 分钟的漂洗,漂洗 2 次即可;
2. 接着,加入约 50 微升的 0.3%Triton ,一次 10 分钟漂洗 4 次;
3. 加入约 50 微升 3%的驴血清(用 0.3%Triton 进行配制而成),在常温下孵育 30 分钟进行封闭;
4. 加入约 50 微升用 0.03%Triton 稀释的一抗,然后进行 4℃ 孵育过夜即可;
5. 加入约 50 微升 PB 配制的 0.3%triton,在常温下进行漂洗 4 次,10 分钟一次;
6.加入约 50 微升 PB 配制的 0.03%Triton 稀释的二抗,在常温下放置 1 小时;
7. 加入约 50 微升 0.1M PB 进行漂洗,总共漂洗 3 次,10 分钟一次;
8. 加入约 50 微升的 DAPI 工作液(1 比 10000),室温孵育 4 到 8 分钟左右即可;
9. 加入约 50 微升 0.1M PB,在常温下进行漂洗,总共漂洗 3 次,10 分钟一次;
10. 最后,取适量 pH8.5 的封闭液进行封片,晾干即可拍照。
注意事项:
1. 固定脱水之后要保证样品较为新鲜的情况下进行处理,不宜放置过久。存储于 -80℃ 的样品,取出后需进行烤片 30-60min,防止浮片。
2. 若所用抗体的特异性较弱,可在 0.1M PB 清洗之后用抗原修复液在常温下修复十分钟。
3. 血清封闭液的选择,解决此问题可以用二抗来源的正常血清代替 BSA 做封闭液,降低抗体浓度,增加洗涤次数,洗涤至少三次,每次 10 分钟。
4. 一抗的浓度不能只参考说明书要求,为找到适宜的荧光强度需在第一次使用时设置浓度梯度。一抗孵育需 4℃ 过夜,第二天可进行回收,回收后的抗体可重复使用 3 次左右。
5. 共染时务必注意种属源性。一抗的种属来源不同,二抗的种属来源需对应一抗的属性。
6. 封片时需注意无气泡,动作轻缓,同洗涤时一样,做到轻柔,防止最后一步出错导致前功尽弃。
7. 必须将存留于切片上的多余的 PBS 甩干,切片上 PBS 存留过多,将会稀释加入的抗体,影响加入抗体的浓度,同时也将影响最后的结果,如假阴性等。
加入的抗体以一滴为佳,约 50微升,加入后,轻微地摇匀地覆盖于切片上,使最后的结果稳定均衡。
8. 在实验过程中不可干片,全程要在湿盒中进行,除最后一步封片。
其主要原因是防止非特异性染色(尤其是在做 BrdU 增殖染色时,要注意 37℃ 孵育一小时中不可干片,否则最后无法正常染色)。
共定位效果较好的图片:
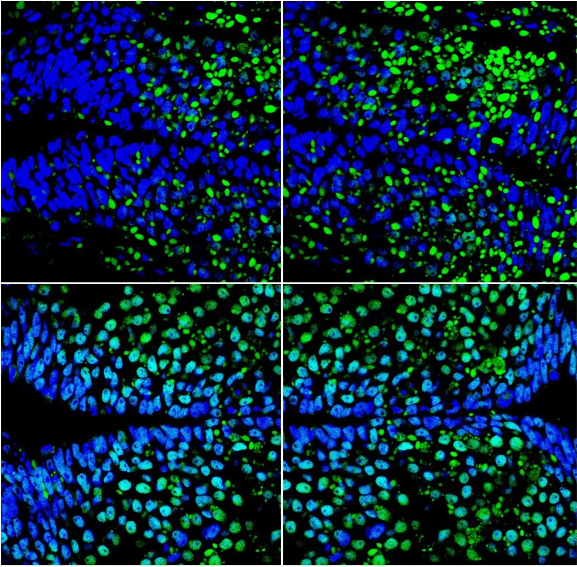
图一
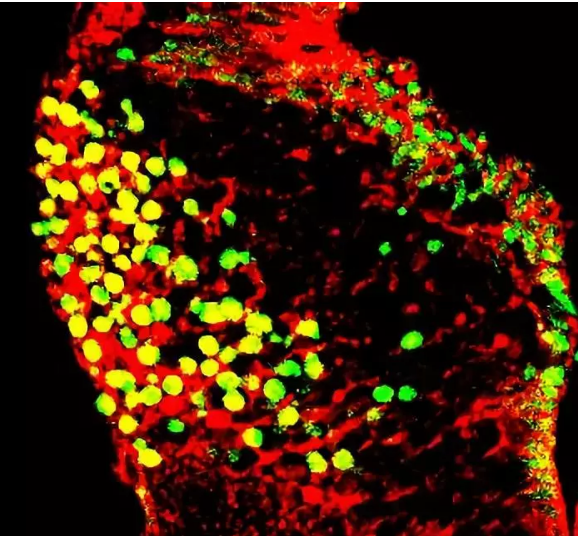
图二
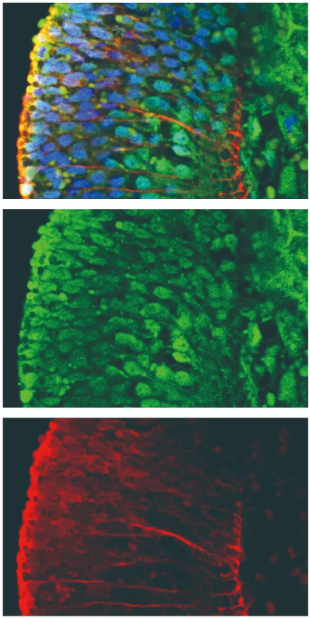
图三
激光共聚焦显微镜拍摄时的注意事项:
1. 首先我们要熟悉激光共聚焦的使用方法,开机和关机顺序要注意,尤其是激光器的使用,务必要预热 10 到 15 分钟方可打开激光。
2. 在 smart set up 中选择 best signal,对应相应的激光波长选择相应的颜色(488-FITC,568-RHOD,647-White,后期也可在软件中进行修改)。
3. 拍摄过程中要注意选择的像素和拍摄速度,一般选择 102undefined1024,speed 为 5-7。
4. Pinhole 值不宜过大,在操作过程中可点击 1AU-Max,获得荧光强度适宜的图层。
5. 为拍摄出完美的荧光图,可通过调整 Gain 值改变荧光强度,再通过调整 Digital Offset 和 Digital Gain 来降低背景噪音以及调整荧光强度。(作者:不 2 兔,图片:不 2 兔,封面:丁香通)