「细思极恐」!Cell 力作,病毒基因感染期间与人类基因融合产生全新蛋白!
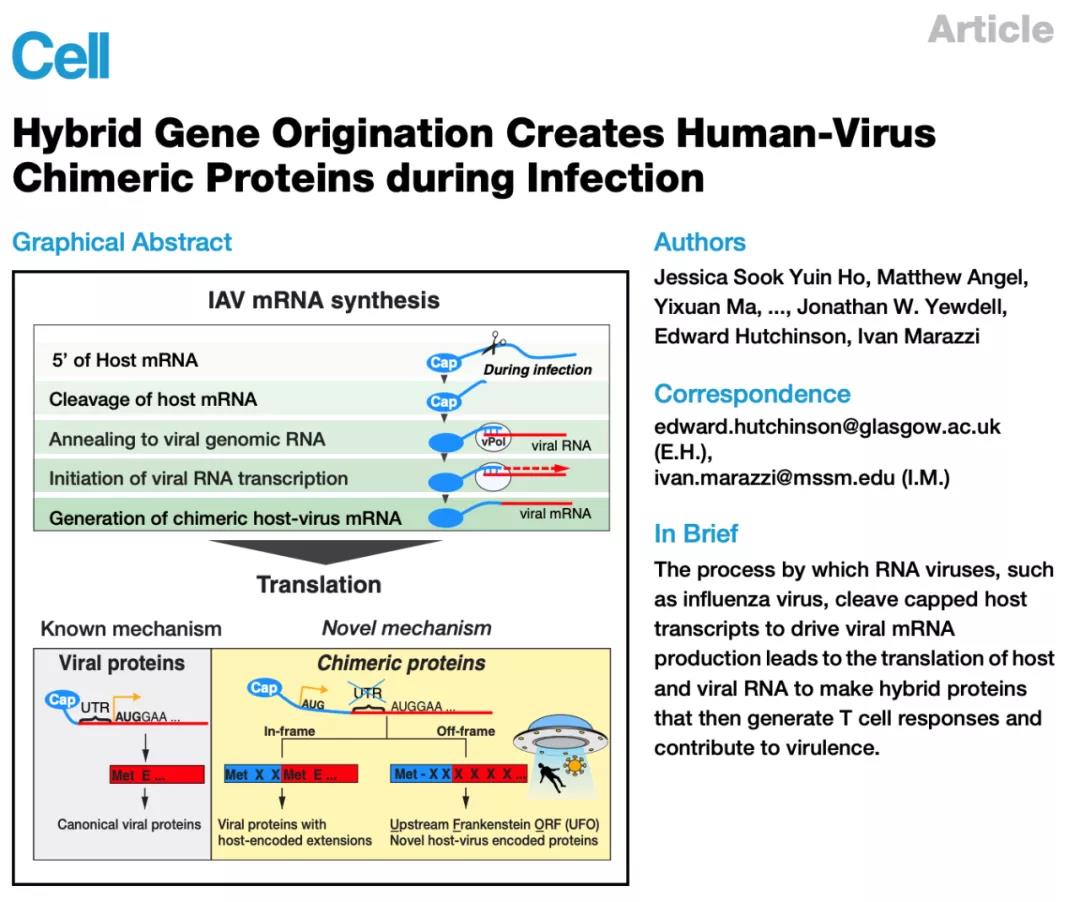
作为一种独特的存在,自然界中的病毒「黑」进宿主细胞,利用后者的转录与翻译系统为自己合成所需的蛋白后大量增殖是它们的看家本领。包括流感病毒和拉沙病毒在内的分节段的负链 RNA 病毒(Segmented Negative-Sense RNA virus, sNSV)拥有着一套独特的翻译系统。他们可以通过切割携带 m7G 帽结构的宿主转录产物后与自己 mRNA 的连接来绑架宿主细胞为自己翻译合成蛋白,这种现象被称为「帽抢夺」(cap-snatching)。尽管学术界对 sNSV 的「帽抢夺」现象早已熟知,但该过程对病毒的毒性和人体免疫响应强弱的影响还未被广泛研究。
图片来源:Cell
2020 年 6 月 18 号,来自美国纽约市西奈山伊坎医学院的 Ivan Marazzi 教授带领团队在 Cell 上提前在线发表了题为 Hybrid Gene Origination Creates Human-Virus Chimeric Proteins during Infection 的论文 [1],首次报道了在病毒感染期间病毒与人类融合产生的杂交基因能够在人体内产生未知的全新蛋白,并揭示了这些融合蛋白对人体造成的影响。
研究内容
「起始抢夺」现象的理论基础
图片来源:Cell
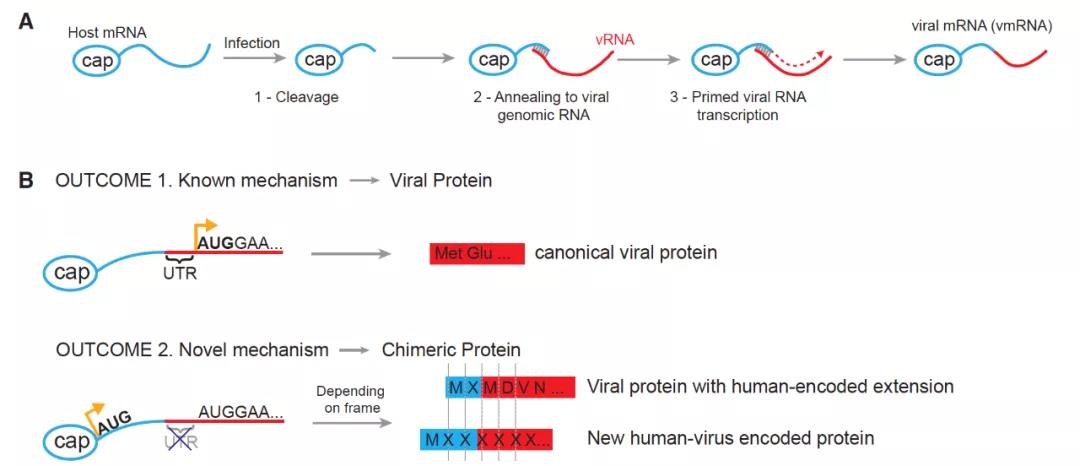
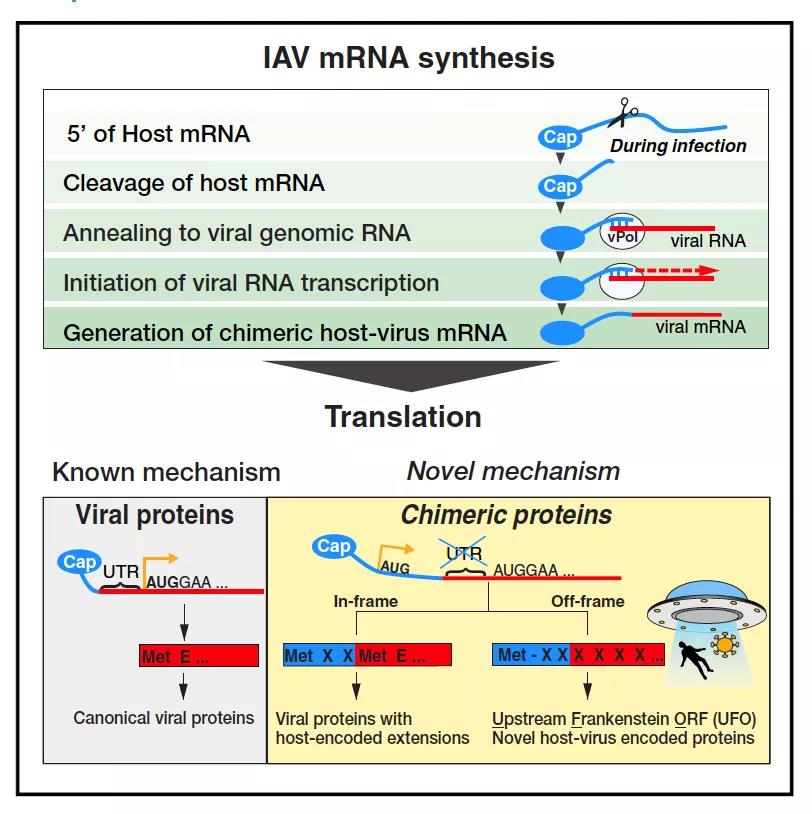
在正常情况下,A 型流感病毒 (influenza A virus, IAV) 在帽抢夺后的翻译是从其自己的病毒 mRNA 序列的 5′ UTR 后开始的。研究人员直接大胆假设了另外一种可能,那就是在流感病毒帽抢夺宿主 mRNA 后,由于上游序列存在宿主自己的上游起始密码子(uAUGs),将翻译产物的整个 5′ UTR 提前而得到加长版的人类 - 病毒融合蛋白,研究人员将这个现象命名为「起始抢夺」(start-snatching)。与病毒在「帽抢夺」中夺走宿主 RNA 的帽子一样,作者认为它们也能夺走宿主 RNA 的起始密码子为自己所用。
图片来源:Cell
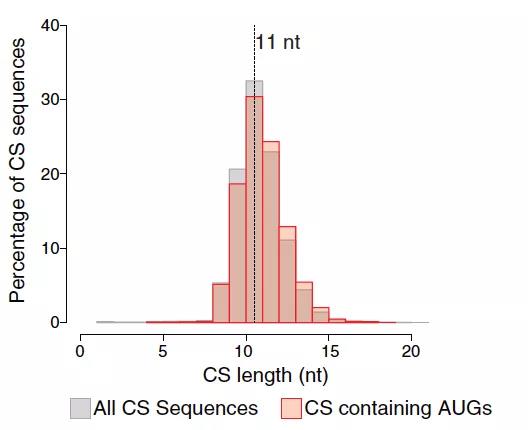
为了验证这个假设,研究人员首先探究了能够发生帽抢夺现象的宿主上游序列中是否存在 uAUGs。通过分析之前的 DEFEND-seq 的数据库,作者发现这种 uAUGs 在帽抢夺后产生的人类 - 病毒的杂交基因中广泛存在,提示了「起始抢夺」现象存在的可能。

图片来源:Cell
另一方面,研究人员也一直清楚的意识到:只有起始密码子是不够。宿主起始密码子的引入势必会导致移码,原病毒 mRNA 序列中可能会由于移码产生新的终止密码子序列,导致翻译提前停止而得不到完整的肽段 / 蛋白。所以研究人员下一步要确认的是移码不会导致翻译的提前终止。
IAV 由 8 个 RNA 节段组成,作者通过生物信息学手段分析了 IAV 的 8 个节段在「起始抢夺」宿主 RNA 后中终止密码子出现的情况。并显示其中 5 个节段的翻译过程中至少有一个阅读框在移码后不会提前终止,这些数据在理论层面上提示了人类 - 病毒融合蛋白存在的可能。
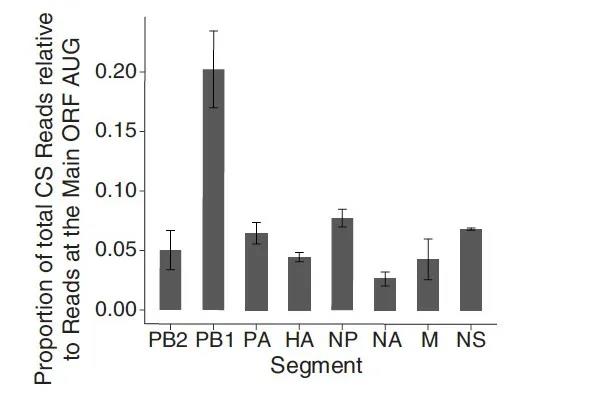
图片来源:Cell
为了验证人类 - 病毒融合蛋白在体内真实存在,研究人员探究了核糖体和起始密码子结合的情况。在正常情况下,核糖体会与翻译序列的 5’端结合,形成核糖体保护片段(Ribosome-protected fragments,RPFs)。对被感染细胞的 RPFs 分析过后,研究人员发现,除了帽抢夺后在病毒 RNA 序列产生经典 RPFs 之外,还有着为数不少的发生在宿主序列的 RPFs,比例大概是经典 RPFs 的 5-20%。作者还进一步确认了这些在宿主序列的 RPFs 能正常启动翻译过程。尽管它们的频率低于经典病毒翻译途径,关于 RPFs 的数据让我们离人类 - 病毒融合蛋白的存在又更近了一步。
人类 - 病毒融合蛋白真实存在且影响病毒毒性
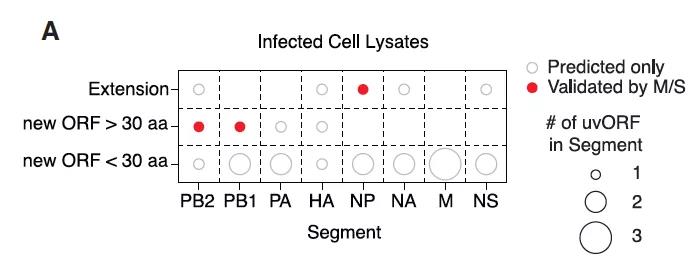
图片来源:Cell
最后,研究人员进行了最后一步验证。那就是确定这种融合蛋白是否能够被真正完整地表达出来。在受病毒感染的细胞裂解液中,研究人员找到两个病毒 PB1 和 PB2 节段的加长肽段,并将其命名为 PB1-UFO 和 PB2-UFO(UFO 代表 Upstream Frankenstein ORF,上游弗兰肯斯坦 ORF:小说人物弗兰肯斯坦以创造缝合怪而闻名,以此象征人类 - 病毒蛋白的融合),也确认了 NP 节段的延长版本,NP-ext(NP-extension)。这三种加长肽段的含量尽管比正常病毒蛋白的含量低很多,但也足以被常规方法检测。
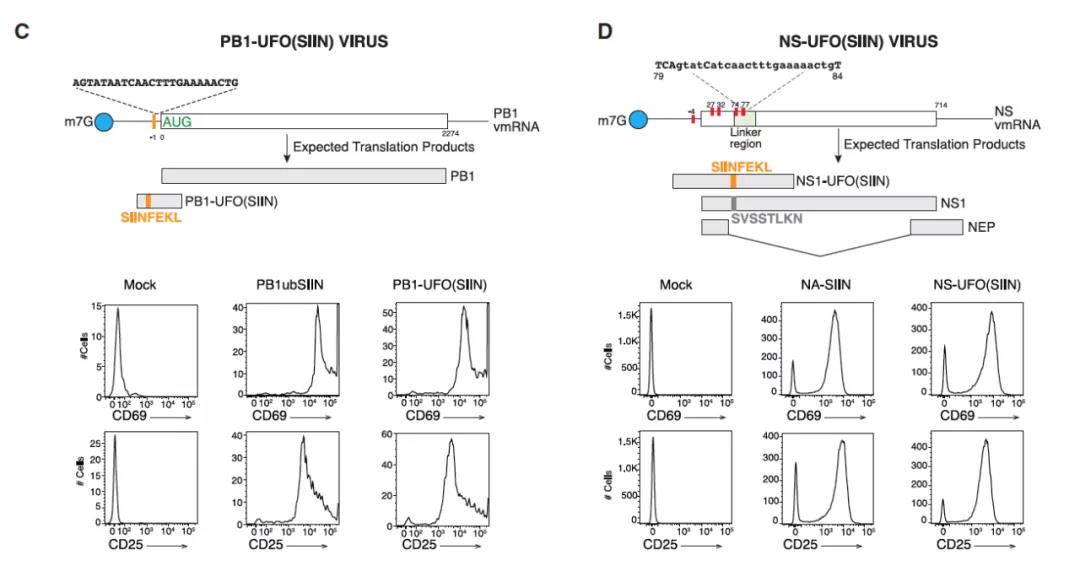
图片来源:Cell
随后,研究人员探究了这些加长肽段能否被人体的免疫系统识别。通过在体外构建 PB1-UFO 和 NS-UFO 的类似物 pB1-UFO (SIIN) 和 NS-UFO (SIIN),并组成完整病毒。作者探究这些融合蛋白对人体的影响。结果显示,两种融合蛋白病毒与正常病毒相比,对 T 细胞响应没有明显差别,证明融合蛋白病毒一样可以被人体识别。
这些数据证明了人类 - 病毒融合蛋白所构建的病毒和普通病毒一样,能触发人体的免疫反应,而且人类 - 病毒融合蛋白能够影响病毒毒性。
人类 - 病毒融合蛋白现象广泛存在
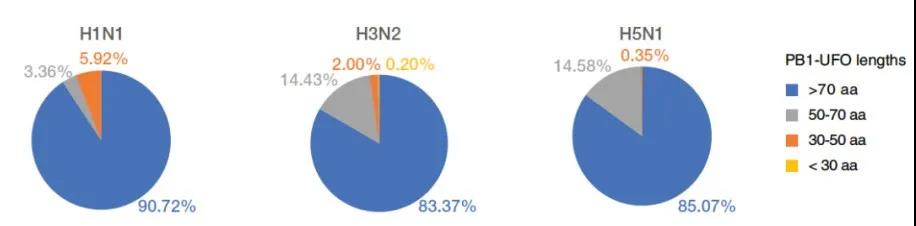
图片来源:Cell
在确定了人类 - 病毒融合蛋白的存在和功能后,研究人员想知道这种杂交现象是不是广泛存在。通过对比甲流病毒亚型 ΗΙΝ1,Η3Ν2,Η5Ν1 中融合蛋白 相关序列。作者发现人类 - 病毒融合蛋白在各亚型和毒株中高度保守,说明这并不是个别毒株或者亚型中的偶发现象。
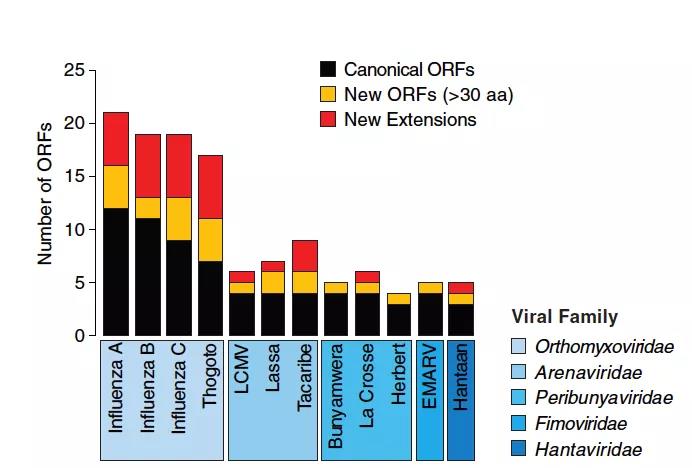
图片来源:Cell
最后,作者确认了「起始抢夺」在包括流感病毒、拉沙病毒等多种 sNSVs 中广泛存在,其存在造成了大量病毒翻译过程中新 ORFs 的产生,并通过这个机制产生宿主 - 病毒融合蛋白。
研究意义
图片来源:Cell
该研究从 sNSVs 的「帽抢夺」机制出发。大胆假设,小心求证,证明了「起始抢夺」现象的存在,并揭示了 sNSVs 的是如何通过「起始抢夺」现象产生人类 - 病毒融合蛋白。作者提出一个明确的假设后,通过缜密的计算分析与体内外实验一步步证实了「起始抢夺」导致人类 - 病毒融合蛋白的产生,还发现这些全新的人类 - 病毒融合蛋白能够影响病毒毒性以及人体的免疫响应。该机制可能是病毒毒性演化的基础,也毫无疑问会给人类在病毒生物学,病毒演化以及人体免疫监控领域带来全新的见解。
根据作者的生物信息学分析,IAV 中存在的人类 - 病毒融合蛋白的种类远远超过本研究所深入探讨的种类,这或许与实验检测能力有关。这些预测中的人类 - 病毒融合蛋白是否真实存在?对病毒的毒性和人体的反应又有什么影响?都是值得继续探讨的话题。
延伸阅读
该研究不仅发现了一种全新的 sNSVs 翻译机制以其产生的全新宿主 - 病毒融合蛋白,也再次对传统的 5'UTR 定义发起「攻击」。
传统意义上我们认为真核生物 mRNA 在 5' 端后有一段几十到上百碱基长度的非翻译区域 (untranslated region ,UTR), 真正的翻译就是在这段 5'UTR 之后开始。但近年来,越来越多的研究发现上游开放阅读框(upstream open reading frames, uORFs)的存在,这些 uORFs 会导致最后产生的蛋白比我们认知中的蛋白长了那么一段。
这种在起始密码子之前发生翻译的现象也不仅仅存在于此次报道的 sNSVs 中。近年来,学术界发现 uORFs 广泛存在于 T 细胞激活和癌症发生的过程中。

图片来源:PubMed
2016 年,来自加州大学旧金山分校的 Peter Walter 带领团队在 Science 上发表了题为 Translation From the 5' Untranslated Region Shapes the Integrated Stress Response 的论文 [2],报道了 T 细胞在整合应激反应中通过 uORFs 产生不同的翻译产物的现象。

图片来源:Nature
2017 年,来自美国洛克菲勒大学的 Elaine Fuchs 教授带领团队在 Nature 上发表了题为 Translation from unconventional 5′ start sites drives tumour initiation 的论文 [3],证明致癌基因可以在传统意义上的 5’UTR 之前翻译,并揭示了它们对癌症发生的影响。
本次研究揭示连病毒和人类的交互都可能导致翻译在传统的 5’UTR 之前发生,也许,我们要重新考虑对非翻译区域(UTR)的定义了。