PNAS | 蒽环化疗药物心脏毒性的新机制及新药化学合成策略
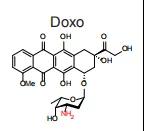
蒽环类药物,主要包括阿霉素(多柔比星,doxorubicin, Doxo)、柔红霉素(Daunorubicin, Daun)、伊达比星(Idarubicin, Ida)和阿柔比星(Aclarubicin, Acla),是一类高效广谱的化疗药物,广泛应用于多种血液系统肿瘤和实体瘤的治疗。
图片来源:PNAS
然而,蒽环类药物的临床应用常受到其心脏毒性的限制。该副作用通常表现为剂量相关的、迟发的和不可逆的心脏衰竭。目前,尚无用于预防和控制的药物,严重的病人只能接受心脏移植。因此,一旦达到指导性的安全累积剂量,患者只能停止蒽环治疗,即使该方案仍然具有良好的抗癌作用。基于该原因,一些心脏功能不佳或年老的癌症病人亦不能接受蒽环化疗方案。

图片来源:站酷海洛Plus
除此之外,化疗导致的治疗相关肿瘤(therapy-related tumors)也是蒽环药物的严重副作用。据不完全统计,大约1–3%的青少年癌症病人和0.2–1%的乳腺癌患者会在初始蒽环治疗的5年内罹患治疗相关肿瘤。通常这类肿瘤比原发肿瘤恶性程度更高,治疗效果差,严重影响患者的总体生存期。另外,蒽环药物的生殖毒性也是严重影响癌症幸存者生活质量的副作用。故而一些处在生育年龄的癌症病人在接受蒽环化疗前会冷冻生殖细胞,但是针对儿童癌症患者尚无有效预防措施。
基于以上原因,如何有效降低蒽环的化疗副作用是癌症治疗领域的一个重要研究方向。上世纪90年代,研究者曾合成了两千余种蒽环化合物,试图找到低毒高效的替代者;此外,也有一些临床实验试图用自由基清除剂来缓解蒽环心脏毒性,但都无功而返。
2020年6月17日,由来自莱顿大学医学中心的Jacques Neefjes教授、荷兰癌症研究所的乔晓杭博士和上海交通大学医学院附属瑞金医院李军民教授等组成的团队,在PNAS杂志上发表题为Uncoupling DNA damage from chromatin damage to detoxify doxorubicin的研究成果[1],揭示了蒽环心脏毒性的新机制,并证实通过化学修饰可以在不影响其抗癌功效的基础上,显著降低Doxo的心脏毒性和其它副作用,为新一代低毒蒽环药物开发提供了化学合成的新思路。

图片来源:PNAS
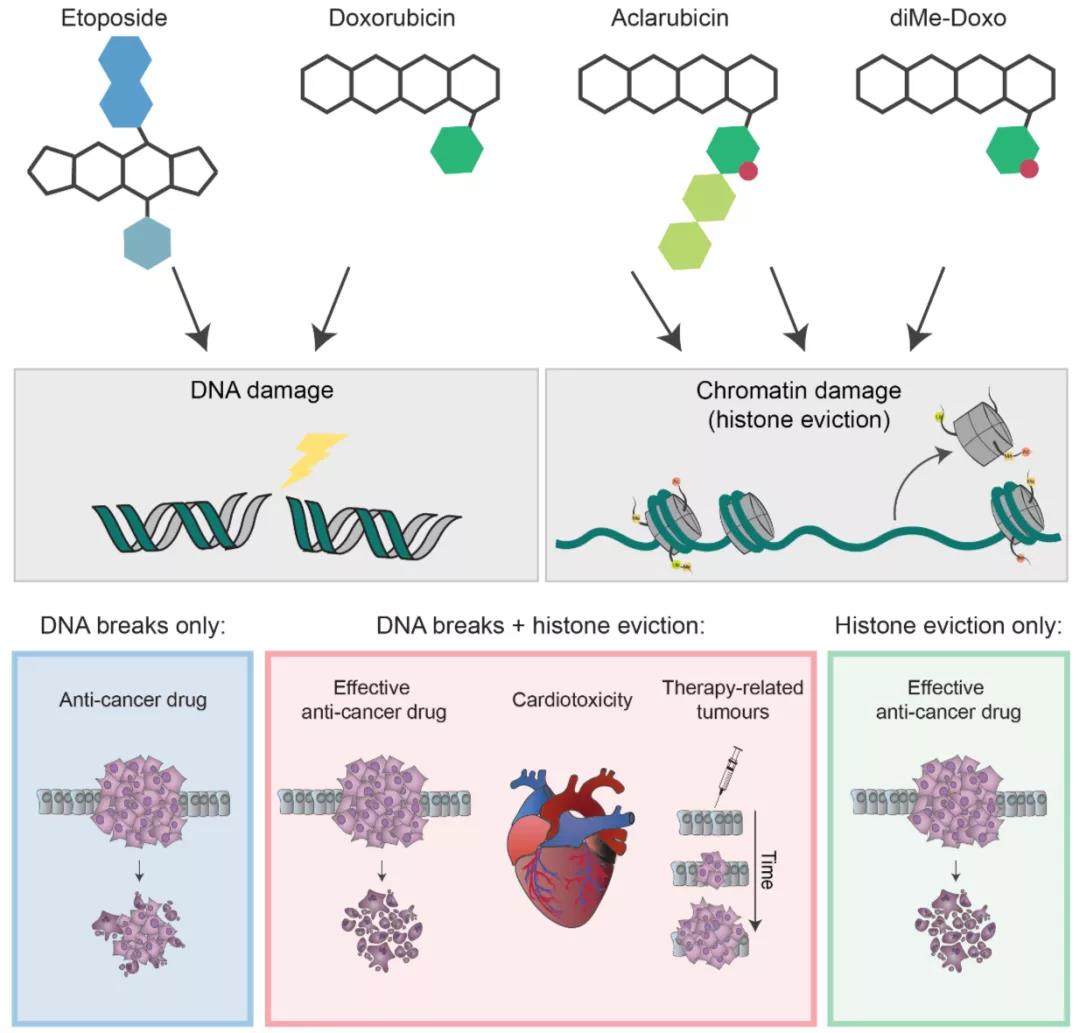
能否有效去除蒽环毒副作用的关键在于造成这些副作用的分子机制是否与其抗癌机制偶联,这决定了能否在不影响蒽环药物抗癌效果的前提下消减其副作用。已知蒽环药物是II型拓扑异构酶(Topoisomerase II, Topo II)抑制剂,通过形成共价Topo II-Doxo-DNA复合物,诱导DNA双链断裂(DNA double-strand break, DSB)。但是拥有相同分子机制的非蒽环药物 ——依托泊苷(Etoposide, Etop),虽然也用于癌症治疗,但其抗癌效果和心脏毒性都弱于蒽环药物。这说明除DNA损伤(DNA damage)之外,蒽环药物还可能存在其它作用机制。
Jacques Neefjes教授和乔晓杭博士,多年来致力于蒽环药物的分子机制研究。2013年,他们和另一课题组各自独立报导了蒽环药物的组蛋白离散(histone eviction)机制,即蒽环药物可以插入DNA双链结构,造成核小体结构崩塌,从而导致多种组蛋白从基因组特定区域脱落(Nat. Commun., 2013)[2]。

图片来源:Nature Communications
2015年,他们又发现这一蒽环独特的分子机制可以导致细胞的表观基因组和转录组发生变化,DSBs修复减缓等一系列后果,并将其统称为染色质损伤(Chromatin damage)(Nat. Chem. Biol., 2015)[3]。通过对常用蒽环药物的分析,他们发现阿柔比星(Aclarubicin, Acla),作为一个特例,只引起染色质损伤而不造成DNA损伤。而且临床上Acla对急性骨髓性白血病(Acute myeloid leukemia, AML)和恶性淋巴瘤等肿瘤也卓有疗效,说明染色质损伤机制本身就具有良好抗癌作用,该发现是蒽环药物作用机制研究的一个重要突破。

图片来源:Nature Chemical Biology
在本次PNAS的文章里,团队又阐述了染色质损伤和DNA损伤两种机制在蒽环毒性中所起作用。作者在小鼠模型中模拟临床用药剂量和疗程给与单药治疗,通过长达一年半的观察,发现只有同时具有DNA损伤和染色质损伤两种功能的Doxo才能诱导小鼠的心脏毒性;而只有DNA损伤功能的Etop和只有染色质损伤功能的Acla则不具有心脏毒性。
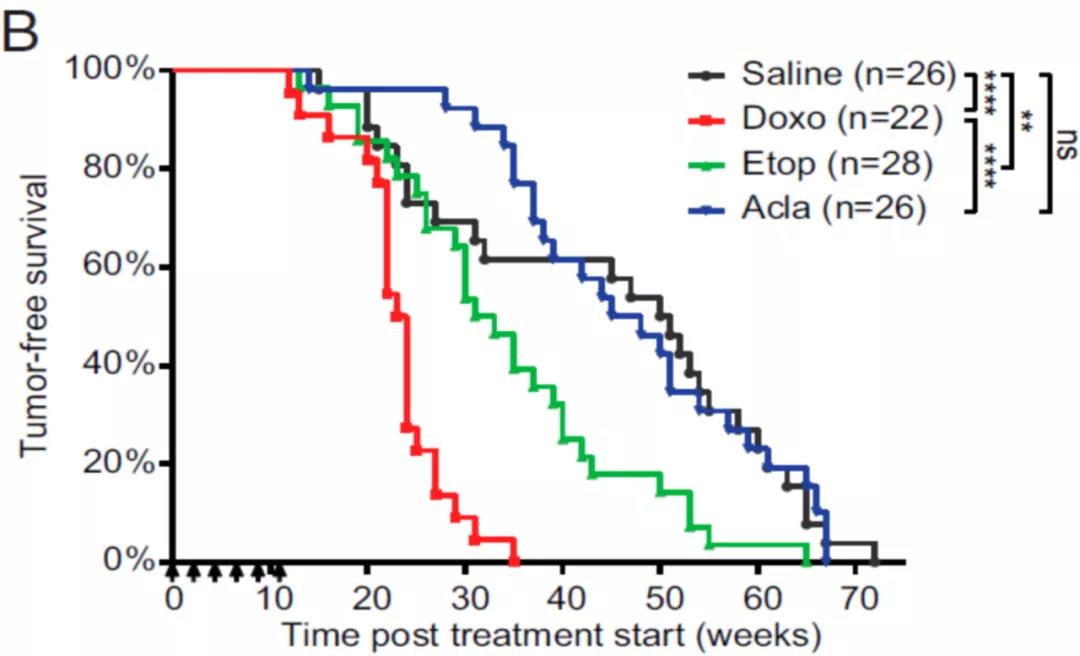
图片来源:PNAS
这一结论在人多能干细胞来源的体外心脏组织模型中也得以验证,并且当Acla与只具有DNA损伤功能的氨柔比星(Amrubicin, Amr)联用时,在功能上模拟了Doxo,造成体外心脏组织电生理特性的紊乱。
由于造成DNA损伤突变,Doxo和Etop处理明显增加Trp53+/-小鼠的癌症发生率;又因为组蛋白离散造成DSB修复减缓和保真度进一步下降,导致Doxo的致癌作用更强于Etop;相反,Acla处理并不影响Trp53+/-小鼠的癌症发生率。这说明单纯染色质损伤机制致癌风险较低,但会协同提高DNA损伤机制的致癌几率。
另外,动物实验还发现Acla和Etop无明显长期生殖毒性,而Doxo则会诱导雌性小鼠的次级和三级卵泡凋亡,长期处理可导致雄性小鼠的无精症。
通过对各蒽环药物分子结构的分析,作者发现与蒽环相连糖链上的氨基对染色质损伤功能非常重要。移除此氨基或将其转移到蒽环上,如Amr结构所示,将导致蒽环药物丢失染色质损伤功能。而糖链氨基的二甲基化则使蒽环药物在Topo II切割DNA之前与之形成复合物,从而去除其DNA损伤功能只保留染色质损伤功能,如Acla所示。据此理解,作者团队合成了N,N-二甲基-Doxo(diMe-Doxo)。
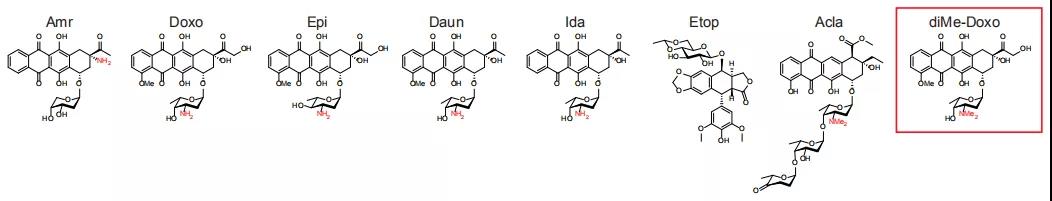
图片来源:PNAS
结果显示只具有染色质损伤功能的diMe-Doxo,同Acla一样,即使加大剂量在动物实验和体外心脏组织中也不引起心脏毒性。而失去DNA损伤功能的diMe-Doxo和Acla,在体内和体外都表现出不弱于Doxo的肿瘤控制和癌细胞杀伤能力。这一发现让人不禁怀疑蒽环药物DNA损伤功能的重要性和必要性。
与Daun/Ida相比,Acla在AML临床治疗方面卓越的效果和相对温和的副作用,进一步证明染色质损伤是蒽环药物的主要抗癌机制且不会引起上述长期副作用。同时,作者也展示了如何通过简单化学修饰去除蒽环副作用,为新一代蒽环药物的开发提供了全新的化学合成思路。
图片来源:PNAS
相信这一成果对蒽环药物的临床应用与研发具有积极的推动作用。其临床转化可以解决老年人、心脏病患者、青少年和育龄癌症患者等接受蒽环治疗时的部分限制,减少因化疗副作用导致的心脏功能损伤、治疗相关癌症的发生以及生殖损害——保证蒽环疗效的同时,扩大适用人群,并极大改善患者生活质量。
荷兰癌症研究所乔晓杭博士和Jacques Neefjes组博士生Sabina van der Zanden为本文共同第一作者;荷兰莱顿大学医学中心Jacques Neefjes教授、乔晓杭博士和上海交通大学医学院附属瑞金医院李军民教授为共同通讯作者。