Sci Adv:红得发紫的 cGAS,再添新功能!哈佛兰利团队发现它是 DNA 复制减速器
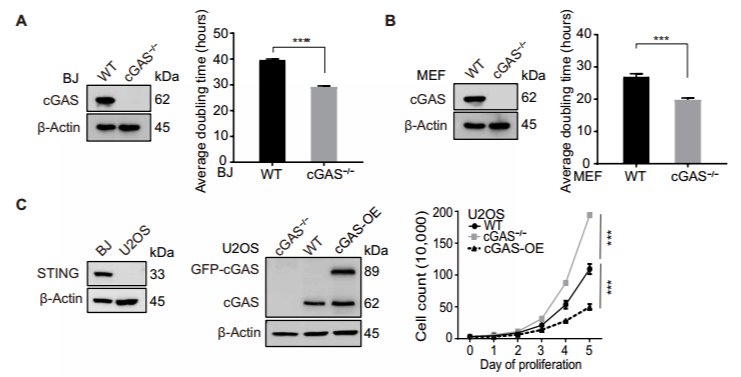
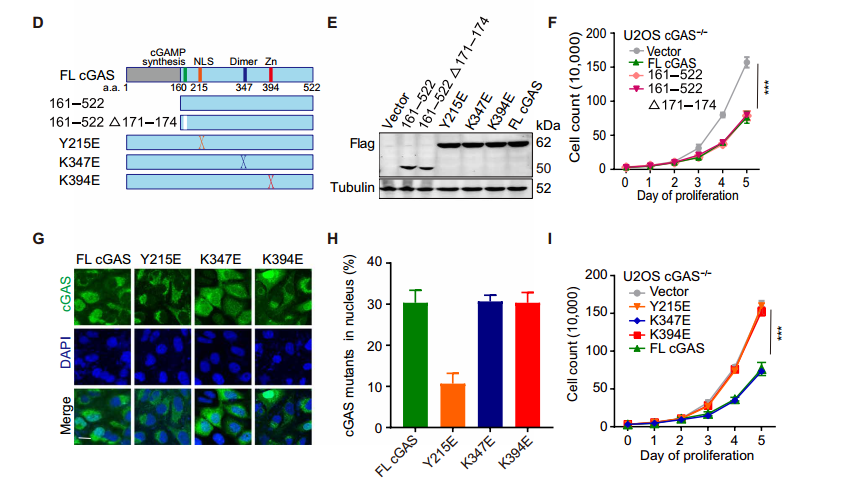
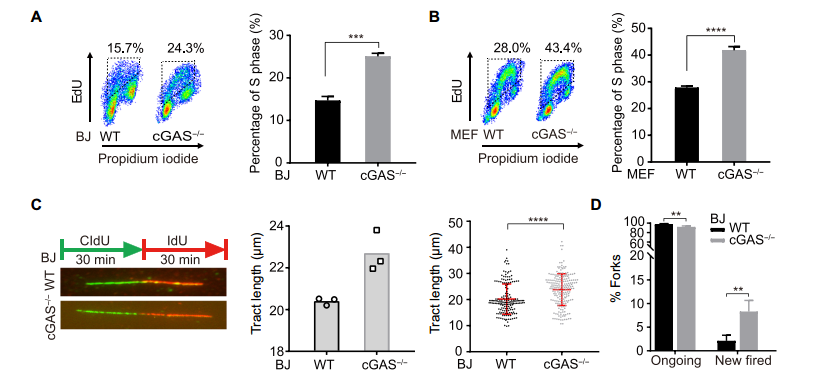
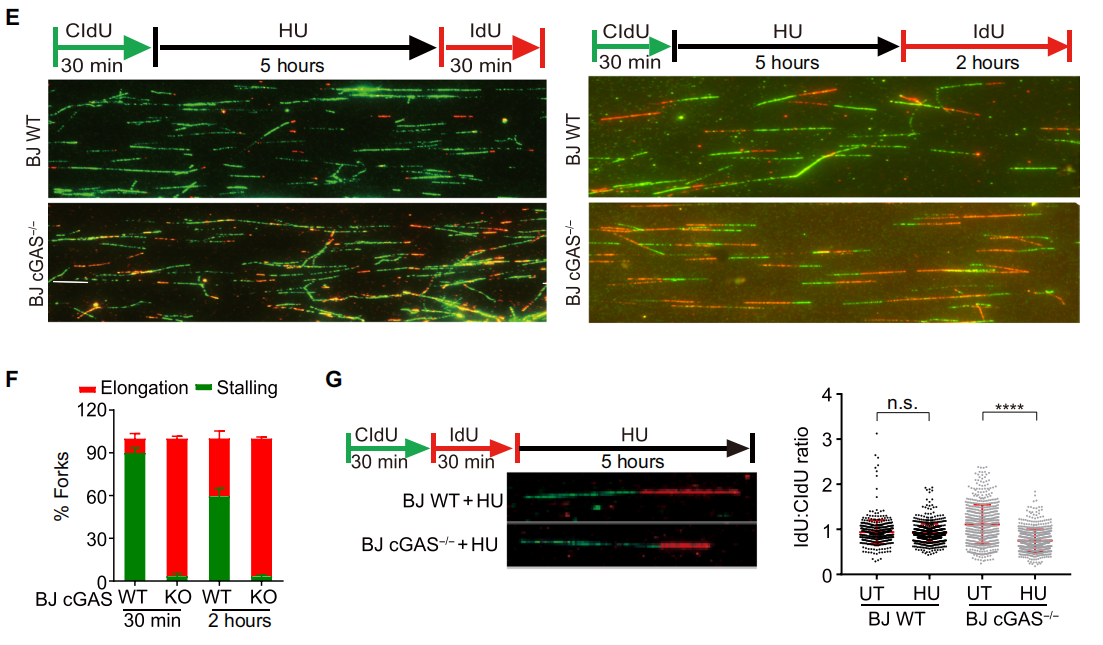
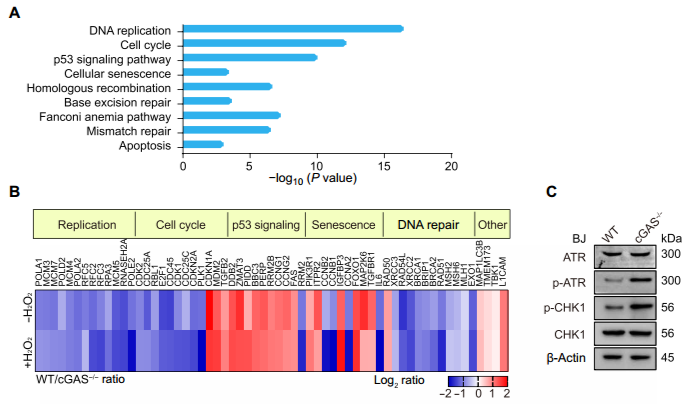
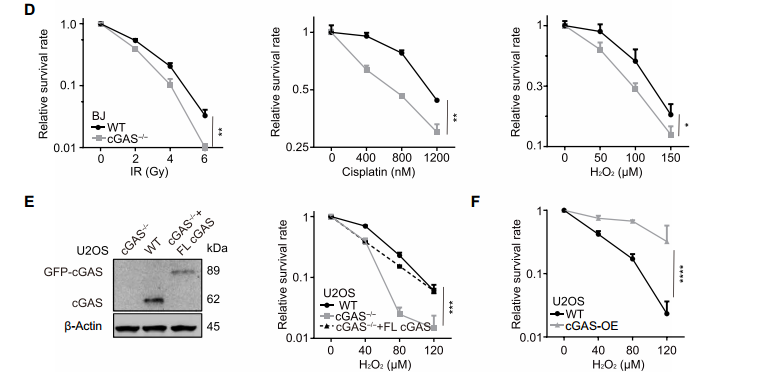
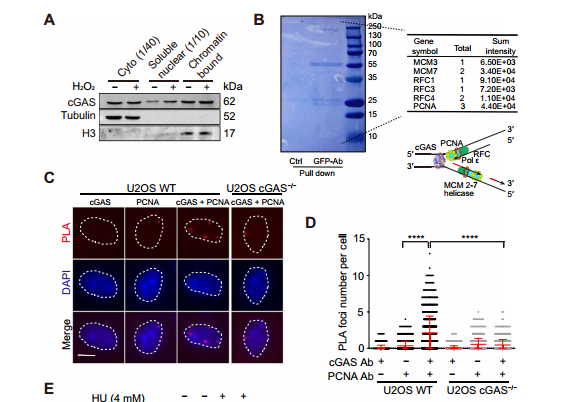
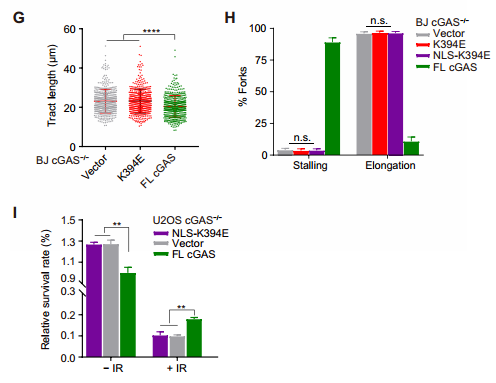
环鸟苷酸 - 腺苷酸合成酶 (cyclic GMP-AMP synthase, cGAS) 是胞质 DNA 的传感器,能够通过 cGAMP-STING 途径刺激 I 型干扰素反应,对于先天免疫反应至关重要。此外,cGAS-STING 途径对肿瘤具有复杂的影响。一方面,某些癌症通过使 cGAS-STING 途径失活而逃避了免疫,但另一方面 cGAS-STING 途径的活化可促进了抗肿瘤免疫力。STING 在癌症中常被抑制,但 cGAS 很少丢失,这提示了 cGAS 可能具有不依赖 STING 的功能。2020 年 10 月 14 日,哈佛医学院兰利课题组于 Science Advances 杂志在线发表题为 cGAS suppresses genomic instability as a decelerator of replication forks 的文章,文章第一作者为陈浩,美国国家科学院院士陈志坚教授课题组参与了这项研究。该研究成功揭示了 cGAS 不依赖 STING 的功能,发现 cGAS 充当 DNA 复制叉的「减速器」,降低细胞复制速率,维持基因组稳定性。这一发现丰富了 cGAS 功能,为 STING 缺乏的肿瘤提供潜在的治疗靶点。cGAS 与细胞核中 DNA 结合,降低细胞增殖速度作者在敲除 cGAS-/- BJ 成纤维细胞中,发现与野生型(WT)细胞相比,cGAS-/- 细胞倍增时间更短且增殖速率更快。与 WT U2OS 细胞相比,不表达 STING 的 cGAS-/- U2OS 细胞增殖速率也增加了。在 WT U2OS 细胞中,稳定过表达 cGAS(cGAS-OE)可降低增殖率,逆转 cGAS 丢失对细胞增殖的影响。综上,cGAS 的缺失导致细胞增殖加速,且不依赖于 STING。作者进一步发现丧失 cGAMP 合成活性的 cGAS 突变体也可以像全长 cGAS 一样挽救 cGAS-/- 细胞的快速增殖,这表明 cGAS 对细胞增殖的影响也不依赖于 cGAMP。随后作者研究了其他几种 cGAS 突变体减慢细胞增殖的能力:cGAS 的 Y215E 突变消除了其核易位;K347E 突变破坏 cGAS 的二聚化,但不影响 DNA 结合;K394E 突变消除了 cGAS 的 DNA 结合。在 cGAS-/- U2OS 细胞中,K347E 突变体表达与全长(Full-length, FL) cGAS 一样降低了细胞增殖速率,而 Y215E 和 K394E 突变体表达却没有这种功能。这提示 cGAS 的入核及 DNA 结合能力是减缓细胞增殖所必需的。为了解 cGAS 缺失如何促进细胞增殖,作者通过流式细胞术检测了 WT 和 cGAS-/- 细胞的细胞周期图。在 cGAS-/-BJ 和 U2OS 细胞群体中,进行大量 DNA 合成的 S 期细胞大大高于相应的 WT 细胞群体。作者进一步 通过 DNA-Fiber 实验发现 cGAS 缺乏会加速复制叉的进程。cGAS-/- 细胞中复制叉的加速促使作者考虑 cGAS 是否改变了停滞的复制叉的重启。作者通过胸苷类似物 5 - 氯脱氧尿苷 (CldU) 和 5 - 碘脱氧尿苷 (IdU) 标记发现 cGAS 缺乏会改变复制叉重新启动的动力学,表现为瞬时停顿之后,复制叉的执行速度更快,并且过早重启。除了复制叉速度之外,停滞的复制叉稳定性是复制动态的另一个关键方面。作者发现羟基脲(HU)降低了 cGAS-/- 细胞中复制束的 IdU:CldU 比,而 WT 细胞中并没有改变,这表明 cGAS 缺乏降低了停滞的复制叉的稳定性。这表明 cGAS 缺失赋予了与复制缺陷相关的过度复制细胞状态。为了进一步表征 cGAS 缺失的影响,作者对 WT 和 cGAS-/- BJ 细胞进行了 RNA 测序。与 cGAS-/- 细胞的过度增殖和复制状态一致,DNA 复制和细胞周期中涉及的基因由于 cGAS 的缺失而显著上调。cGAS-/- 细胞中基因表达的另一个显著变化是 DNA 修复基因的上调,包括与同源重组、错配修复和碱基切除修复有关的基因。 这提示作者 cGAS 缺陷导致基因组不稳定性增加。为了测试在 cGAS-/- 细胞中是否诱导了基因组不稳定性,作者分析了基因组稳定性调控核心激酶 ATR 和 DNA 复制应激的主要传感器 Chk1。与 WT 细胞相比,cGAS-/- 细胞中 ATR 的自磷酸化和 Chk1 的磷酸化都增加了,表明 cGAS-/- 细胞的过度复制状态诱导复制应激并激活 ATR。电离辐射(IR)和化疗药物通过造成 DNA 损伤来杀死癌细胞。鉴于 cGAS-/- 胞过度增殖,作者旨在探究 cGAS 缺失是否会改变细胞对 IR 和化疗的敏感性。用 IR 和遗传毒性试剂(包括 H2O2,依托泊苷,顺铂,HU 和紫外线 C)处理 WT 和 cGAS-/- 细胞,并通过克隆形成实验测量了细胞活力。综上,cGAS 缺失会增加细胞对放射化疗的敏感性。作者研究了 cGAS 如何通过结合细胞核中的 DNA 来减慢复制。为了解 cGAS 如何与染色质上的其他蛋白质相互作用,作者下拉了 cGAS 并使用质谱分析发现,包括 MCM2,MCM3,MCM7,RecC1 和增殖细胞核抗原(PCNA)在内的一组复制叉组分被鉴定为与 cGAS 相互作用的蛋白。此外,cGAS 与 PCNA 共定位在细胞核中,这表明复制叉可能在染色质上遇到 cGAS。随后作者进一步在 cGAS WT 和 KO 细胞中免疫沉淀了 PCNA,并测试了 PCNA 与复制叉蛋白 MCM2,MCM7 和 FEN1 的相互作用。这些相互作用均不受 cGAS 缺失的影响,这表明 cGAS 可能是作为 dsDNA 上的「路障」减慢复制叉。cGAS 与 DNA 结合,减慢复制叉移动速度并抑制 DNA 损伤敏感性为了直接测试结合 DNA 的 cGAS 对复制叉的作用,作者测量了表达 WT cGAS 或 K394E cGAS 突变体的 cGAS-/- BJ 细胞中 DNA 复制轨迹的长度。结果发现 DNA 复制叉在上遇到 cGAS 时会减慢速度。进一步研究发现,与野生型 cGAS 不同,无法结合 DNA 的 cGAS NLS-K394E 突变体未能逆转 cGAS KO U2OS 细胞的过度增殖和 IR 敏感性。因而,cGAS 与 DNA 结合对减慢复制叉移动速度并防止复制相关的 DNA 损伤至关重要。
该研究确定了 cGAS 通过充当 DNA 复制的「减速器」来维持基因组稳定性。作者发现 cGAS 缺失导致与基因组不稳定相关的基因过度复制,而 cGAS 可以与细胞核中 DNA 结合、与复制相关蛋白相互作用,以减缓复制叉移动速度,降低细胞对 DNA 损伤的敏感性。因此,cGAS 除了是胞质 DNA 的传感器外,更是 DNA 复制动力学的减速器和基因组不稳定性的抑制剂。更值得一提的是,STING 在相当大部分的癌症中均受到抑制,从而使这些癌症对抗肿瘤免疫具有抵抗力。因而本研究发现 cGAS 不依赖于 STING 的功能,有望成为 STING 缺陷型肿瘤的潜在治疗靶点。兰利教授短评:
特别感谢文章第一作者陈浩的工作,感谢美国哈佛大学邹力教授课题组和美国国家科学院院士陈志坚教授课题组参与这项研究,和他们给予的支持。
前期很多研究瞩目细胞核内的 DNA 被 cGAS 识别以后为何没有激活免疫反应,此研究揭示了核内的 DNA 和 cGAS 结合后的调控免疫应激以外的重要功能,我们认为 cGAS 在核内还有很多新的功能值得探索。
![]()