Nat Metab:汤其群 / 郭亮团队发现半胱氨酸双加氧酶促进脂肪分解的新功能
丁香学术
脂肪组织分为三种类型,其中白色脂肪负责储存能量,棕色和米色脂肪可以将营养物质代谢产生的能量以热能的形式释放,用于维持体温。棕色脂肪的激活和白色脂肪的米色化,可以增加机体能量消耗,是抵抗肥胖的有效策略。
在寒冷条件下,机体激活脂肪组织的脂肪分解(脂解)过程,分解甘油三酯产生甘油和游离脂肪酸,为整个适应性产热过程提供能量代谢的底物。一些游离脂肪酸还能作为配体,激活 PPARα 等核受体的功能,进而促进产热相关基因、脂肪酸氧化基因的表达,激活米色脂肪和棕色脂肪功能。ATGL(由 Pnpla2 编码)是催化甘油三酯分解第一步反应的限速酶。脂肪组织特异性敲除 ATGL 的小鼠更容易发生肥胖,寒冷耐受能力严重受损,同时伴随棕色脂肪的白色样改变 [1]。HSL(由 Lipe 编码)负责催化甘油三酯分解的第二步反应。增加小鼠脂肪组织 HSL 的活性抑制了高脂饮食诱导的肥胖、胰岛素抵抗以及肝脏脂肪变性 [2]。这说明脂肪组织脂解在调控机体适应性产热、能量代谢及影响肥胖发生发展中发挥重要作用。转录因子 PPARγ 可以促进 ATGL 和 HSL 的表达从而促进脂解 [3],然而其具体调控机制尚未完全阐明。
2022 年 10 月 17 日,汤其群/郭亮团队在 Nature Metabolism 上发表了题为 Cdo1 promotes PPARγ-mediated adipose tissue lipolysis in male mice 的研究成果。该研究发现,脂肪组织 Cdo1 受到寒冷诱导上调,能够通过 PPARγ/Med24/lipolysis 信号通路,转录激活脂解基因 ATGL 和 HSL 的表达,从而增加小鼠脂肪组织脂解、寒冷耐受能力和能量消耗,进一步抵抗小鼠肥胖及代谢紊乱。
研究团队为了深入研究米色/棕色脂肪激活的分子机制,分离了 4℃ 冷暴露 24 小时和室温饲养小鼠的皮下脂肪组织以及分化成熟的棕色脂肪细胞(分化第 6 天)和前棕色脂肪细胞(-2 天),进行 RNA-seq 检测。从中筛选鉴定出候选效应分子半胱氨酸双加氧酶 1(Cysteine Dioxygenase 1,Cdo1)。与室温组小鼠/前棕色脂肪细胞组相比,小鼠冷暴露 24 小时皮下脂肪组织/成熟棕色脂肪细胞中 Cdo1 表达显著增加。进一步的研究还发现,Cdo1 主要在脂肪组织的成熟脂肪细胞中表达;饥饿同样能够促进脂肪组织 Cdo1 表达的上调;高脂肪饲料(HFD)诱导小鼠肥胖后则导致脂肪组织 Cdo1 表达的下降。
前人研究表明,Cdo1 在小鼠脂肪组织、肝脏等器官存在较高水平的表达。Cdo1 的全身性敲除小鼠出生后出现一定比例的死亡,存活下来的小鼠会表现为发育不良、骨骼弯曲、生长迟缓,这说明 Cdo1 对于机体的生长发育及正常生命活动十分重要。在 3T3-L1 脂肪细胞中,转录因子 PPARγ 和 C/EBPα 可以结合到 Cdo1 启动子上 [4]。这一研究提示 Cdo1 在脂肪组织中可能发挥着重要的功能。
Cdo1 是生物体自身合成牛磺酸的关键酶。研究团队前期采用药理学手段,腹腔注射 Cdo1 代谢终末产物牛磺酸,发现牛磺酸可以促进小鼠脂肪组织棕色化进而抵抗肥胖,该研究工作于 2019 年发表在 Journal of Biological Chemistry 杂志 [5]。 然而在生理条件下,Cdo1 在脂肪组织发挥的具体作用及其分子机制有待深入研究。在本项研究中,研究人员采用雄性的脂肪组织特异性敲除 Cdo1 小鼠(Cdo1AKO)以及脂肪组织特异性 Cdo1 转基因(Cdo1TG)小鼠,对上述问题进行了深入的研究。

Cdo1 催化的氨基酸代谢路径。
研究人员发现,Cdo1AKO 小鼠能量消耗降低,对寒冷刺激不耐受,脂肪组织脂解能力显著降低,棕色脂肪组织游离脂肪酸含量下降,更容易发生高脂饲料诱导的肥胖及肥胖相关的代谢紊乱(胰岛素抵抗、血脂异常、脂肪肝等)。RNA-seq 显示,Cdo1AKO 小鼠皮下脂肪组织脂解信号通路相关基因下调最为明显。然而 Cdo1AKO 小鼠脂肪组织牛磺酸没有明显变化,这可能是由于机体代偿性从血液循环中摄取更多的牛磺酸所致。
研究团队发现 Cdo1 在成熟脂肪细胞核存在定位,并且 Forskolin、CL316,243 介导的肾上素能信号通路能够促进 Cdo1 的核定位。进一步研究发现 Cdo1 能够通过和 PPARγ 及 Med24 相互作用,促进 Med24 招募到脂解基因 ATGL 和 HSL 的启动子上,从而转录激活上述脂解基因的表达。Med24 是 Mediator Complex 核心亚基之一。Mediator Complex 可以促进转录前起始复合物(Preinitiation complex,PIC)的形成进而促进基因的转录。有趣的是,Cdo1 酶活性缺失的突变体(Y157F)能够和野生型 Cdo1 一样促进 Med24 招募到脂解基因的启动子上并转录激活脂解基因。因此 Cdo1 调控脂解基因表达的功能可能不依赖于其氨基酸代谢酶的活性。此外, Cdo1TG 促进雄性小鼠脂肪组织脂解,增加能量消耗及寒冷耐受能力,并抵抗高脂饲料诱导的肥胖及胰岛素抵抗等相关代谢紊乱。
该研究揭示了脂肪组织 Cdo1 在适应性产热及维持能量代谢稳态中的重要作用,发现了 Cdo1/PPARγ/Med24/Lipolysis 的转录调节新路径,阐明了氨基酸代谢酶 Cdo1 调控脂肪代谢的新功能和新机制,为预防和治疗肥胖提供了新的思路和潜在干预靶点。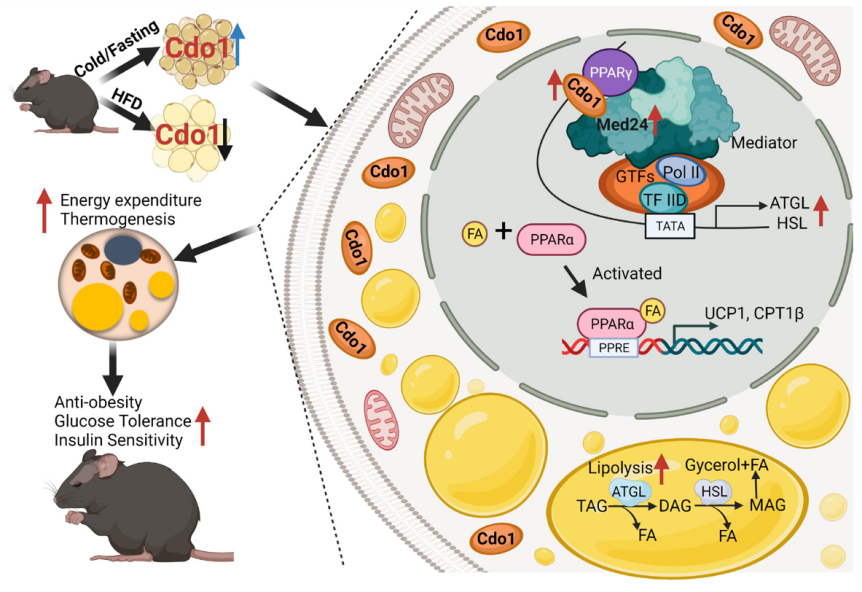
Cdo1 调控脂解的模式图(图片已获 BioRender 授权)。
复旦大学基础医学院 2019 级博士研究生郭盈盈为本文的第一作者,复旦大学基础医学院汤其群教授和上海体育学院运动健康学院、上海市运动与代谢健康前沿科学研究基地郭亮教授为本文的共同通讯作者。该工作得到国家重点研发计划项目和国家自然科学基金重点项目、面上项目的资助。